Myokinase
Définition
La myokinase est une enzyme kinase, synonyme de adénylate kinase 1 (ADK1). Elle catalyse l'interconversion de nucléotides de l'adénine, un processus impliqué dans l'homéostasie de l'énergie cellulaire. L'ATP transfère un groupe phosphate (phosphotransférase) à l'AMP pour former l'ADP. Le triphosphate organique peut aussi agir comme un donneur de phosphate. La myokinase ne représente que ADK1/AK1 de l'adénylate kinase (qui compte 9 isoenzymes).
Structure de la myokinase :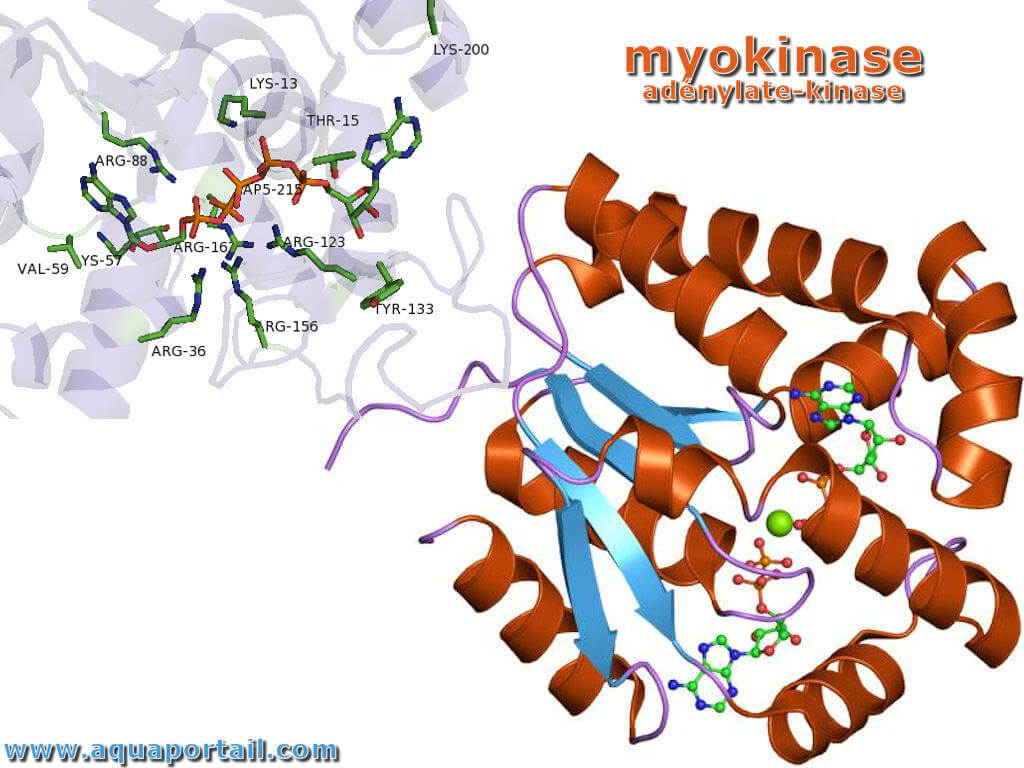
La myokinase (ici pour la mycobactérie de la tuberculose Mycobacterium tuberculosis) a une structure cristalline.
Explications
La myokinase transfère de manière réversible le phosphate de l'ATP à l'AMP, formant ainsi deux molécules d'ADP. L'enzyme est spécifique des nucléotides adénine et ne catalyse la réaction qu'en présence d'un ion métallique divalent (Mg2+, Ca2+, Co2+, Mn2+, ou Ni2+).
Dans le muscle de nombreuses espèces de vertébrés et d'invertébrés, la concentration de l'ATP est de 7 à 10 fois supérieure à celle de l'ADP, et généralement plus de 100 fois supérieure à celle de l'AMP. Le taux de phosphorylation oxydative est contrôlée par la disponibilité d'ADP. Ainsi, la mitochondrie tente de maintenir les niveaux d'ATP élevé en raison de l'action combinée de l'adénylate kinase et les contrôles de la phosphorylation oxydative.
La myokinase est située dans le cytoplasme de toutes les cellules. Voir aussi l'adényl-cyclase.
La myokinase (EC 2.7.4.3) est une enzyme phosphotransférase catalysant l'interconversion des nucléotides adénine. L'ADK est important dans l'homéostasie de l'énergie cellulaire car il peut constamment surveiller les niveaux de nucléotides de phosphate à l'intérieur de la cellule. La constante d'équilibre est variable selon la condition, mais elle est adjacente à 1. Par conséquent, ΔGo car cette réaction est presque nulle. Dans le muscle de diverses espèces de vertébrés et d'invertébrés, la concentration d'ATP (adénosine triphosphate) est généralement 7 à 10 fois supérieure à celle de l'ADP (adénosine diphosphate), et généralement 100 fois supérieure à celle de l'AMP (adénosine monophosphate). La disponibilité de l'ADP contrôle le taux de phosphorylation oxydative. Par conséquent, la mitochondrie tente de maintenir des niveaux d'ATP élevés en raison de l'action combinée de l'ADK et des contrôles sur la phosphorylation oxydative.
Structure
La flexibilité et la plasticité font que les protéines se lient aux ligands pour former des oligomères, s'agréger et effectuer des travaux mécaniques. De grands changements conformationnels dans les protéines sont essentiels pour la signalisation cellulaire. L'ADK est une protéine de transduction du signal et, par conséquent, l'équilibre entre les conformations pourrait réguler l'activité des protéines. ADK contient un état déplié localement qui devient dépeuplé lors de la liaison.
Il a été montré qu'il existe trois conformations ou structures pertinentes d'ADK-CORE, Open et Closed. Il existe deux petits domaines appelés LID et NMP dans ADK. L'ATP se lie dans la poche formée par les domaines LID et CORE et l'AMP se lie dans la poche formée par les domaines NMP et CORE. Les régions localisées d'une protéine se déplieraient au cours des transitions conformationnelles, ce qui réduit la souche et améliore l'efficacité catalytique. Le déploiement local est le résultat des énergies de tension concurrentes dans la protéine.
Isoenzymes
Jusqu'à présent, neuf isoformes de la protéine ADK humaine ont été identifiées, dont certaines sont omniprésentes dans tout le corps, tandis que d'autres sont localisées dans des tissus spécifiques. Non seulement les emplacements de diverses isoformes dans la cellule varient, mais également la liaison du substrat à l'enzyme et la cinétique du transfert de phosphoryle sont différentes. La localisation sous-cellulaire des enzymes ADK est mise en oeuvre en incorporant une séquence de ciblage dans la protéine. Chaque isoforme a également une préférence différente pour les nucléosides triphosphates (NTP). ADK a également été trouvé dans différentes espèces bactériennes et levures. Certains résidus sont conservés à travers ces isoformes, indiquant leur essentiel pour la catalyse. L'une des zones les plus conservées est le résidu Arg, dont la modification pourrait inactiver l'enzyme,avec un Asp qui réside dans la fente catalytique de l'enzyme et participe à un pont salin.
Mécanisme
Le transfert de phosphoryle ne survient qu'à la fermeture du ''couvercle ouvert '', ce qui conduit à une exclusion des molécules d'eau pour rapprocher les substrats les uns des autres, abaissant ainsi la barrière énergétique pour l'attaque nucléophile par le groupe γ-phosphoryl de l'ATP sur le α-phosphoryle d'AMP. Dans la structure cristalline de l'enzyme ADK d'E. Coliavec l'inhibiteur Ap5A, le résidu Arg88 se lie à Ap5A au niveau du groupe α-phosphate. Il a été démontré que la mutation R88G provoque une perte de 99 % de l'activité catalytique de cette enzyme, démontrant l'implication intime de ce résidu dans le transfert de phosphoryle. Un autre résidu hautement conservé est Arg119. Il réside dans la région de liaison à l'adénosine de l'ADK et sert à prendre en sandwich l'adénine dans le site actif. La promiscuité de ces enzymes dans l'acceptation d'autres NTP est causée par les interactions relativement insignifiantes de la base dans la poche de liaison à l'ATP. Un réseau de résidus positifs conservés (Lys13, Arg123, Arg156 et Arg167 dans ADK de E. c oli) est utilisé pour stabiliser l'accumulation de charge négative sur le groupe phosphoryle pendant le transfert. La liaison de deux résidus d'aspartate distaux avec le réseau d'arginine provoque le repli de l'enzyme et réduit sa flexibilité. Un cofacteur de magnésium est également nécessaire pour augmenter l'électrophilie du phosphate sur l'AMP, bien que cet ion magnésium ne soit maintenu dans la poche active que par des interactions électrostatiques et se dissocie facilement.
Fonction
La capacité d'une cellule à mesurer dynamiquement les niveaux énergétiques nous permet de surveiller facilement les processus métaboliques. L'ADK pourrait réguler la dépense énergétique au niveau cellulaire en surveillant et en modifiant en permanence les niveaux d'adénylphosphates. Au fur et à mesure que les niveaux d'énergie changent sous différents stress métaboliques, l'ADK est alors capable de générer de l'AMP qui agit comme une molécule de signalisation dans d'autres cascades de signalisation. Les facteurs communs pourraient influencer les niveaux de nucléotides adénine, et par conséquent l'activité ADK sont l'exercice, le stress, les changements dans les niveaux d'hormones et le régime alimentaire. L'ADK facilite le décodage des informations cellulaires en catalysant l'échange de nucléotides dans la "zone de détection" intime des capteurs métaboliques.
L'ADK est présente dans les compartiments mitochondrial et myofibrillaire de la cellule, et elle permet à deux phosphorylases à haute énergie (β et γ) d'ATP disponibles d'être transférées entre des molécules nucléotidiques d'adénine. Essentiellement, ADK transporte l'ATP vers des sites à forte consommation d'énergie et supprime l'AMP généré au cours de ces réactions. En fin de compte, ces relais de phosphotransfert séquentiels pourraient entraîner la propagation des groupes phosphoryle le long des collections de molécules ADK. Ce processus peut être considéré comme une brigade de seau de molécules ADK qui entraîne des changements dans le flux métabolique intracellulaire local sans changements globaux apparents dans les concentrations de métabolites, ce qui est extrêmement essentiel pour l'homéostasie globale de la cellule.
Synonymes, antonymes
Voir tous les synonymes pour "myokinase".3 synonymes (sens proche) de "myokinase" :
- adénylate kinase
- adénylokinase
- EC 2.7.4.3
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à MYOKINASE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot MYOKINASE est dans la page 6 des mots en M du lexique du dictionnaire.
Mots en M à proximité
myofibrille myofibroblaste myofilament myogenèse myoglobine myokinasemyomère myomètre myopie myosepte myosine
En rapport avec "myokinase"
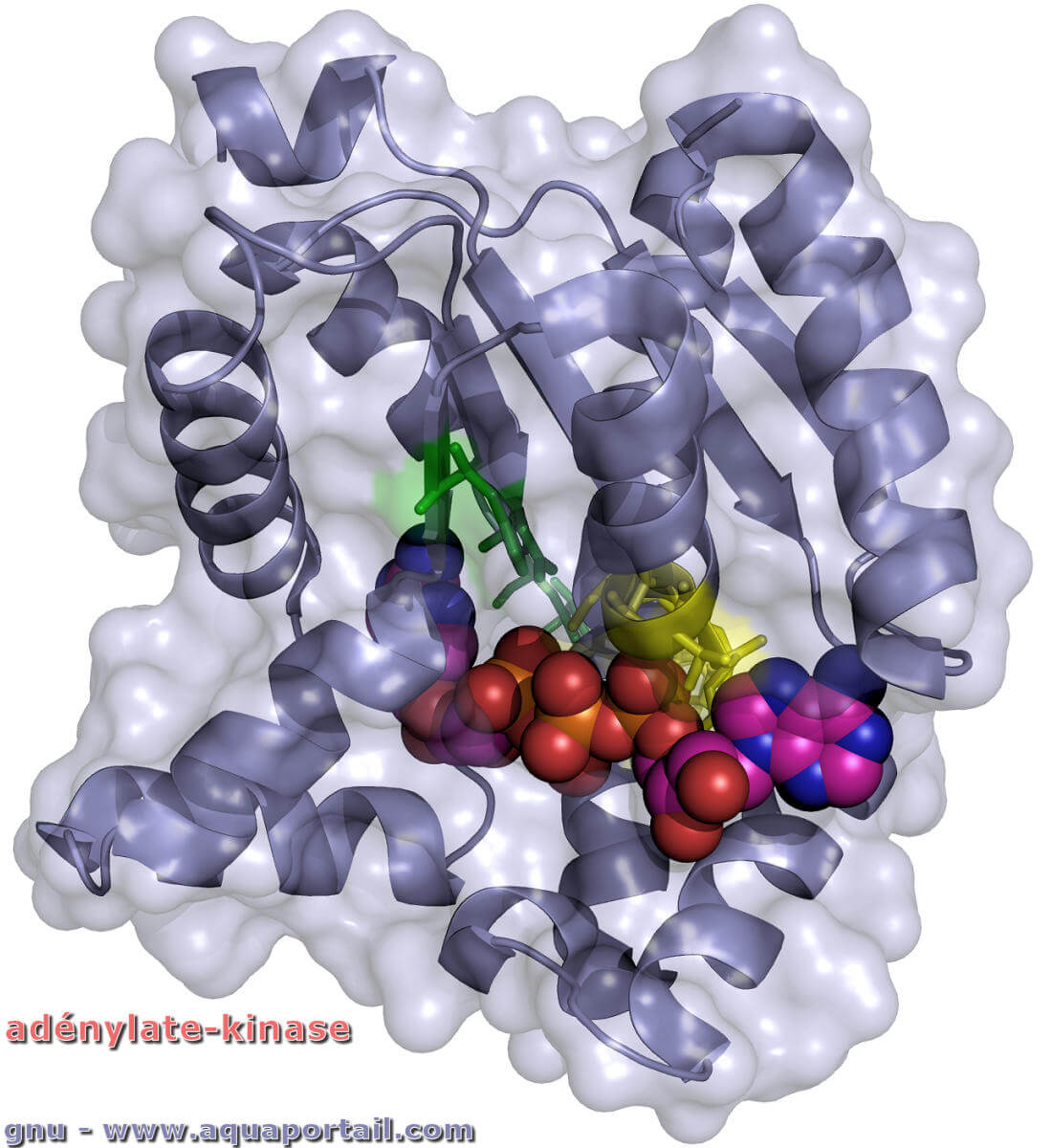
L'adénylate kinase, adényl-kinase ou myokinase, est une enzyme abondante dans les muscles, où elle y catalyse la réaction de transphosphorylation...
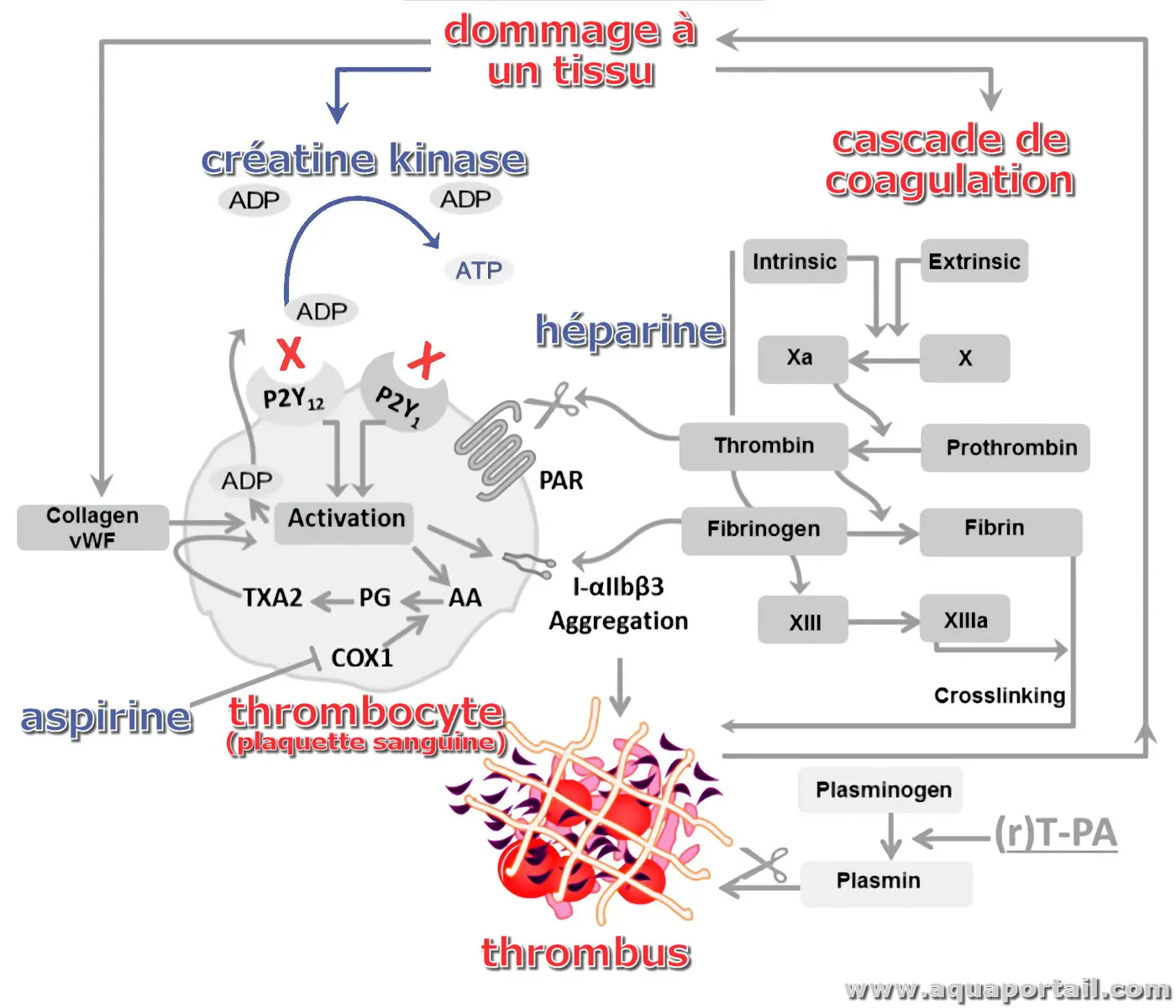
La créatine kinase (CK) est une enzyme spécifique du muscle, et par conséquent, le degré de sa présence dans le sérum peut être utilisé comme marqueur...
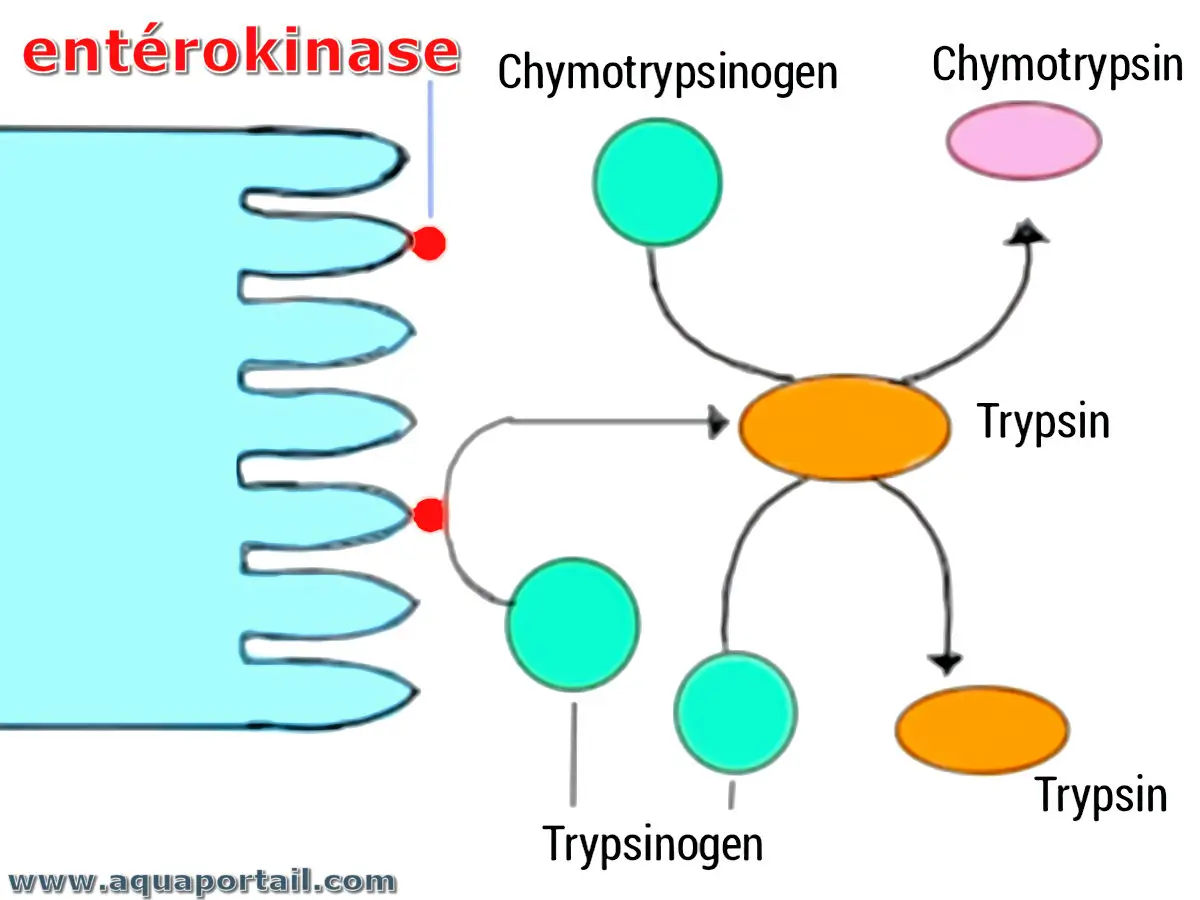
Une entérokinase, ou entéropeptidase, participe à la digestion des protéines. Elle est une enzyme dans l'intestin grêle avec un rôle de conversion...
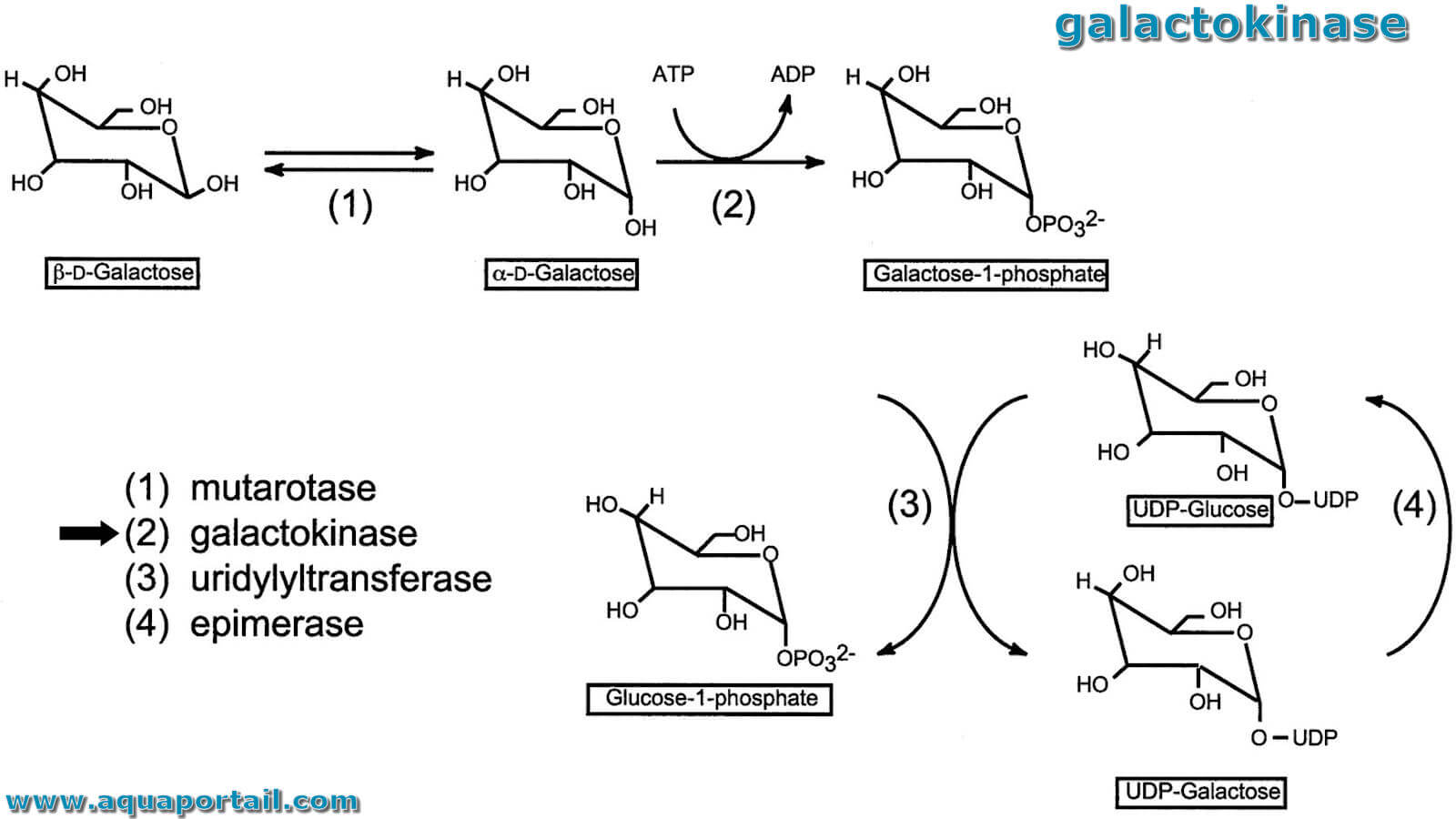
Une galactokinase est une enzyme hépatique (phosphotransférase) qui catalyse la phosphorylation du galactose en galactose-1-phosphate aux dépens d'une molécule...
