Myogenèse
Définition
La myogenèse est le processus de formation ou régénération des muscles squelettiques à partir d'une fusion du couple myoblaste et myocyte. Le muscle squelettique joue un rôle essentiel dans la fonction motrice, l'énergie et le métabolisme du glucose. La fusion de myoblastes mononucléés est une étape cruciale pour former des myofibres multinucléées.
Le processus de myogenèse :
Pendant la myogenèse, des myoblastes normaux (cellules musculaires précoces avec un seul noyau) fusionnant ensemble pour former des myocytes (cellules musculaires multinucléées).
Explications
La myogenèse est la formation de tissus musculaires, en particulier au cours du développement embryonnaire. Les fibres musculaires se forment généralement à partir de la fusion de myoblastes en fibres multinucléées appelées myotubes.
Au cours du développement initial d'un embryon,les myoblastes peuvent proliférer ou se différencier en myotube. Ce qui contrôle ce choix n'est généralement pas clair. Lorsqu'ils sont insérés dans une culture cellulaire,la plupart des myoblastes prolifèrent si un facteur de croissance des fibroblastes (FGF) ou un autre facteur de croissance est présent. Lorsque le facteur de croissance s'épuise, les myoblastes cessent de se diviser et subissent une différenciation terminale en myotubes. La différenciation du myoblaste se fait par étapes.
Au cours de la myogenèse, la fusion myoblaste/myocyte est déclenchée et coordonnée d'une manière spécifique au muscle qui est essentielle pour le développement musculaire et la régénération musculaire post-natale. De nombreuses molécules et protéines ont été trouvées et démontrées comme ayant la capacité de réguler la fusion myoblaste/myocytes.
Fait intéressant, deux protéines membranaires spécifiques au muscle récemment découvertes, Myomaker et Myomixer (également appelées Myomerger et Minion), ont été identifiées comme des régulateurs fusogènes chez les vertébrés.
La glycogène synthase kinase 3 (GSK3) ralentit la différenciation myogénique et la fusion des myoblastes en partie en inhibant la voie de signalisation Wnt/β-caténine. Le lithium, un médicament courant pour le trouble bipolaire, inhibe la GSK3 via la compétition Mg+ et une phosphorylation accrue de Ser21 (GSK3α) ou Ser9 (GSK3β), conduisant à une meilleure fusion des myoblastes et à une différenciation myogénique.
Phases (étapes) de la myogenèse
La première phase implique la sortie du cycle cellulaire et le début de l'expression de certains gènes.
La deuxième phase de la différenciation implique l'alignement des myoblastes les uns avec les autres. Des études ont montré que même les myoblastes de souris et de poulets peuvent se reconnaître et s'aligner les uns avec les autres, suggérant la préservation évolutive des mécanismes impliqués.
La troisième phase est la fusion cellulaire elle-même. À ce stade, la présence d'ions calcium est cruciale. Chez la souris, la fusion est facilitée par une série de métalloprotéinases appelées meltrini et une variété d'autres protéines encore à l'étude. La fusion consiste à amener de l'actine dans la membrane plasmique, puis à créer un pore qui s'élargit ensuite rapidement.
Les nouveaux gènes (Myomaker et Myomixer) et leurs produits protéiques qui sont exprimés au cours du processus, font l'objet d'études actives dans de nombreux laboratoires. Il s'agit notamment des éléments suivants :
- Facteurs d'amélioration des myocytes (MEF), qui favorisent la myogenèse.
- Facteur de réponse sérique (SRF), qui joue un rôle central au cours de la myogenèse, étant nécessaire à l'expression des gènes de l'alpha-actinine. L'expression de l'alpha-actinine squelettique est également régulée par le récepteur des androgènes; certains stéroïdes peuvent donc réguler la myogenèse.
- Facteurs régulateurs myogéniques (MRF); il y en a quatre : MyoD, Myf5, Myf6 et Myogénine.
Régénération musculaire
Le processus de myogenèse au cours de la régénération musculaire, après un incident qui a déchiré une fibre musculaire par exemple, est identique à la formation. Lors d'une lésion musculaire squelettique, les cellules satellites (SC) quiescentes sont activées et subissent plusieurs transitions d'état, notamment l'activation, la prolifération, la différenciation, la fusion et la maturation. Chaque état peut être distingué par l'expression de facteurs transcriptionnels, tels que Pax7 et MyoD.
Stade prolifératif de la myogenèse au cours de la régénération musculaire :
L'expression du TNFα et de l'IFNγ est élevée au stade prolifératif de la myogenèse au cours de la régénération musculaire et peut contribuer à coordonner les processus inflammatoires et myogéniques en activant les macrophages au phénotype M1 tout en augmentant la prolifération des cellules satellites et en inhibant la différenciation.
La coordination du processus de myogenèse (formation de nouveau tissu musculaire) implique la coopération de nombreux autres composants cellulaires et moléculaires. En particulier, l'apparition, le développement et la résolution de la réponse inflammatoire jouent un rôle déterminant dans la régulation de la myogenèse.
Macrophages et myogenèse
Les macrophages sont une source précoce majeure d'IGF-1 au cours de la myogenèse. Le knock-out conditionnel de l'IGF-1 dans les macrophages entraîne un dysfonctionnement de la prolifération des cellules satellites à la suite d'une blessure, ainsi qu'une diminution du passage à un phénotype de macrophage restaurateur exprimant CD206.
La régénération musculaire est un processus étroitement régulé qui implique une variété de types cellulaires tels que les cellules satellites, les myofibres, les progéniteurs fibroadipogéniques, les cellules endothéliales et les cellules inflammatoires. Parmi ces différents types cellulaires, les macrophages ont émergé comme un acteur central coordonnant les différentes interactions cellulaires et processus biologiques. En particulier, il a été démontré que la transition des macrophages de leur phénotype pro-inflammatoire à leur phénotype anti-inflammatoire régule l'inflammation, la myogenèse, la fibrose, la vascularisation et le retour à l'homéostasie. D'autre part, il a été démontré que la dérégulation de l'accumulation ou de la polarisation des macrophages dans les troubles musculaires dégénératifs chroniques altère la régénération musculaire. Compte tenu des rôles clés des macrophages dans le muscle squelettique, ils représentent une cible attrayante pour de nouvelles approches thérapeutiques visant à atténuer divers troubles musculaires.
Les monocytes et les macrophages sont des cellules myéloïdes prédominantes qui s'accumulent chronologiquement dans le muscle squelettique au début de l'inflammation induite par une blessure. Il existe de nombreuses preuves indiquant que les macrophages sont des régulateurs clés de différents processus biologiques impliqués lors de la régénération des muscles squelettiques, tels que la myogenèse, la fibrose, l'inflammation et la revascularisation. D'autre part, dans les affections dégénératives chroniques, l'afflux excessif et désorganisé de macrophages stimule la nécrose musculaire, la fibrose et la réparation musculaire défectueuse. Par conséquent, la régulation spatio-temporelle de l'inflammation est vitale pour une régénération efficace du muscle squelettique.
Par rapport à l'image juste ci-dessus, l'activation de TNFα de NFκB dans les macrophages M1 peut favoriser ces effets en activant davantage l'expression de TNFα et d'IFNγ dans les macrophages M1. Une rétroaction positive supplémentaire pour l'activation de M1 et la prolifération des cellules satellites peut survenir par l'activation du TNFα de l'expression de l'activine A par les cellules musculaires. L'augmentation de l'expression et de la libération de l'activine A par les cellules musculaires, qui a un effet autocrine sur les cellules musculaires, inhibe la différenciation et maintient les cellules musculaires au stade prolifératif de la myogenèse. L'activine A libérée favorise également l'expression du TNFα dans les macrophages via une voie de signalisation SMAD2/3, maintenant le phénotype M1. Enfin, l'hypoxie, secondaire à des lésions vasculaires du tissu lésé, active l'expression de gènes sous le contrôle transcriptionnel de HIF1α, ce qui favorise le phénotype M1 dans les macrophages et entraîne la prolifération des cellules satellites.
Cependant, la signalisation du TNFα via p38 MAPK peut favoriser le phénotype des macrophages M2, contrairement à l'activation médiée par NFκB du phénotype M1. Au fur et à mesure que la réponse inflammatoire passe à un milieu dominé par les cytokines Th2, l'IL-10 favorise davantage le phénotype M2 et désactive les macrophages M1. L'IL-10 peut également agir directement sur les cellules musculaires par le biais de mécanismes pouvant favoriser la régénération. L'IL-4, une cytokine Th2 qui est exprimée par les éosinophiles et les cellules musculaires dans le muscle régénératif, augmente encore l'activation de M2 grâce à une signalisation qui peut être médiée par le facteur 4 de type Kruppel (KLF4) ou la signalisation PPARγ. L'IL-4 peut également stimuler la régénération et la croissance musculaires par des actions directes sur les muscles ou par l'intermédiaire des FAP.
Myomaker et Myomixer
Myomaker et Myomixer-Myomerger-Minion sont deux protéines membranaires (microprotéines) qui ont la capacité de contrôler directement le processus de fusion myogénique partie de la myogenèse). Myomaker (MYMK) et Myomixer (MYMX) sont les facteurs de fusion des myoblastes, des gènes codants pour les protéines.
La découverte, la structure, le modèle d'expression, les fonctions et la régulation de Myomaker (gène MYMK) et Myomixer-Myomerger-Minion (gène MYMX) montre l'interaction entre Myomaker et Myomixer-Myomerger-Minion, ainsi que leurs rôles régulateurs coopératifs dans la fusion cellule-cellule.
Les maladies associées à MYMK comprennent le syndrome de Carey-Fineman-Ziter et la myopathie, l'aréflexie, la détresse respiratoire et la dysphagie à début précoce. Un paralogue important de ce gène est PGAP6.
Myomaker (MYMK) est une protéine spécifique aux myoblastes qui médie la fusion des myoblastes, une étape essentielle pour la formation de fibres musculaires multinucléées. Il Participe activement à la réaction de fusion membranaire en médiant le mélange des lipides membranaires cellulaires (hémifusion) en amont de MYMX. MYMK agit indépendamment de MYMX (Myomixer). Il est impliqué dans la régénération des muscles squelettiques en réponse à une blessure en médiant la fusion de cellules satellites, une population de cellules souches musculaires, avec des myofibres blessées. Il est également impliqué dans l'hypertrophie des muscles squelettiques, probablement en médiant la fusion de cellules satellites avec des myofibres.
Myomixer (MYMX) est impliqué dans la fusion membranaire en aval de l'étape de mélange des lipides médiée par MYMK. Il agit en générant des contraintes membranaires via son extrémité C-terminale extracellulaire, entraînant la formation de pores de fusion. MYMX agit indépendamment de MYMK. Il est impliqué dans la régénération des muscles squelettiques en réponse à une blessure en médiant la fusion de cellules satellites, une population de cellules souches musculaires, avec des myofibres blessées.
Les domaines d'exploration de Myomaker et Myomixer-Myomerger-Minion dans les études futures sont de plus en plus examinés pour leur application potentielle pour contrôler la fusion cellulaire à des fins de thérapie cellulaire.
Synonymes, antonymes
Voir tous les synonymes pour "myogenèse".3 synonymes (sens proche) de "myogenèse" :
- formation des tissus musculaires
- genèse des muscles
- myogénie
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à MYOGENÈSE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot MYOGENESE est dans la page 6 des mots en M du lexique du dictionnaire.
Mots en M à proximité
myocyte myofibre myofibrille myofibroblaste myofilament myogenèsemyoglobine myokinase myomère myomètre myopie
En rapport avec "myogenèse"
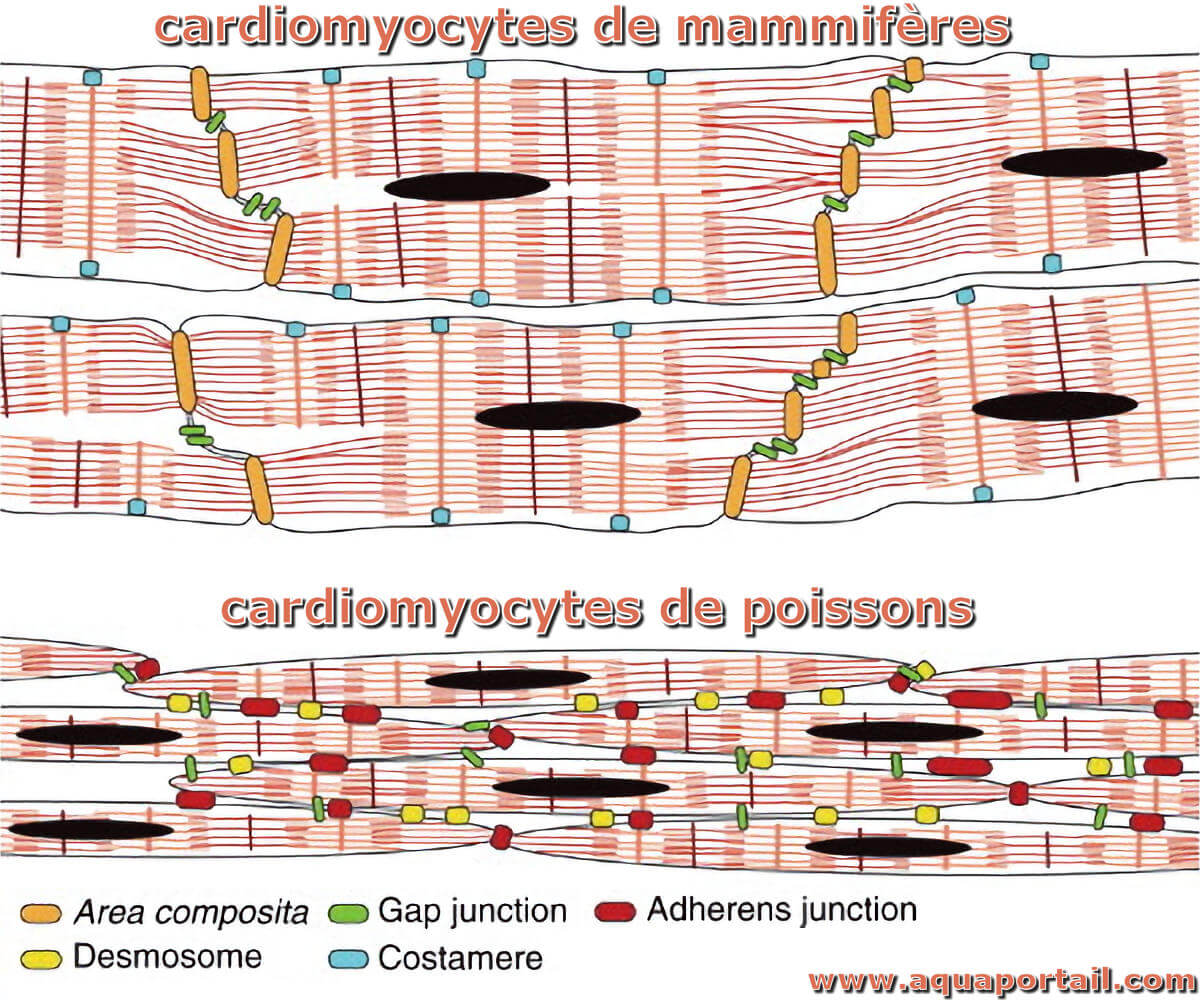
Un cardiomyocyte est la cellule responsable de la contraction du coeur. Les myocytes cardiaques utilisent un réseau complexe de protéines contractiles...
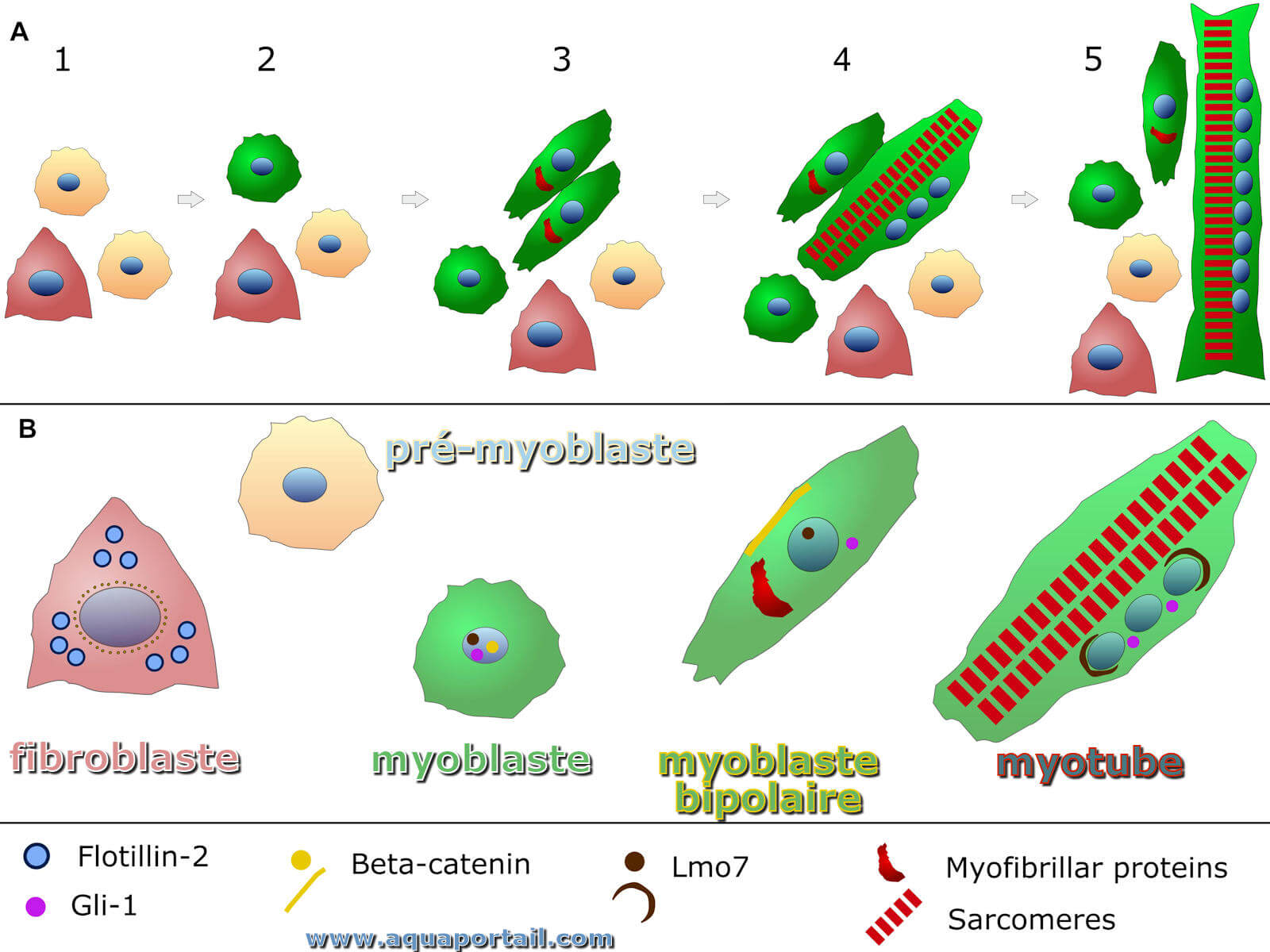
Un myoblaste est une cellule indifférenciée capable de donner naissance à des cellules musculaires.

Un myocyte est une fibre, musculaire, une cellule de muscle du tissu musculaire capables de contractions.

Les myofibroblastes sont des fibroblastes spécialisés avec des caractéristiques intermédiaires entre les fibroblastes et les cellules musculaires lisses.
