Chlorure
Définition
Un chlorure est un composé avec l'anion chlore Cl- dans un état d'oxydation -1. Tout chlorure est à l'état d'oxydation le plus bas de l'élément Cl puisqu'il a complété la couche de valence avec huit électrons. Les composés organiques avec du chlore lié à un groupe alkyle sont également des chlorures.
La fleur de sel est du chlorure de sodium :
Le chlorure de sodium NaCl est le sel de table, y compris la fleur de sel récoltée en marais salants.
Explications
La formule d'un chlorure est XCl, où X est un atome pouvant se lier à l'ion chlore. Le chlorure d'hydrogène est HCl, soit l'acide chlorhydrique. Le chlorure de sodium est NaCl, soit le sel de table.
Le chlorure le plus connu est celui du sodium qui est le sel de mer présent dans l'eau de mer avec une concentration d'environ 3–3,5 %. Par conséquent, les océans et les marais représentent une source pratiquement inépuisable de chlorure.
Les chlorures sont des composés de l'élément chimique chlore. IL peut être associé à des métaux, des demi-métaux ou des non-métaux. Des chlorures de métaux tels que le chlorure de sodium et de cobalt (II) sont des sels d'acide chlorhydrique, mieux connus sous le nom d'acide chlorhydrique (formule chimique : HCl). Un tel chlorure contient dans son réseau ionique du chlore simplement chargé négativement (-I) - des ions Cl- (habituellement appelés ions chlorure).
Le sel se dissout dans l'eau et forme ensuite des ions Na+ et Cl-. Le sel de cuisine normal est présent sur la croûte terrestre en grande quantité dans l'eau de mer. L'ion chlorure est présent à des concentrations plus faibles même dans l'eau douce et dans de nombreuses boissons couramment utilisées. Dans le corps humain, le chlorure préside à des fonctions biologiques importantes et se retrouve, entre autres, dans le sang.
Les chlorures non métalliques tels que le chlorure d'hydrogène, les chlorures de soufre, le tétrachlorure de carbone (tétrachlorure de carbone) et le dioxyde de chlore sont beaucoup plus volatils en tant que composés moléculaires que les chlorures salins. Les hydrocarbures chlorés sont considérés et nommés dans les composés organiques comme des dérivés des composés les plus divers des hydrocarbures. Ainsi, le méthane, dans lequel un atome d'hydrogène a été remplacé (substitué) par un atome de chlore, est appelé chlorométhane ou chlorure de méthyle. Cependant, le chlore n'est pas présent comme ion chlorure, comme dans le cas des composés ioniques mentionnés ci-dessus, mais il est lié de manière covalente à l'atome de carbone. Cependant, le chlorure n'est dans le vrai sens que l'abréviation de l'ion chlorure simplement chargé négativement. Des amines organiques se forment avec des chlorhydrates organiques d'acide chlorhydrique contenant des ions chlorure.
Les chlorures peuvent être obtenus par réaction d'une base (oxyde, hydroxyde, carbonate, etc.) et d'acide chlorhydrique.
Certains métaux non nobles réagissent également directement avec le chlorhydrate donnant l'hydrogène élémentaire et le chlorure correspondant. La réaction directe des éléments est également possible, bien que dans de nombreux cas, elle soit très violente.
Des chlorures covalents sont également possibles. Quelques exemples sont le pentachlorure de phosphore, le trichlorure d'azote et le tétrachlorure de silicium. Le dichlorure de soufre S2Cl2 est utilisé dans la vulcanisation du caoutchouc.
Les chlorures, comme les autres halogénures, peuvent se comporter comme des ligands et former des composés complexes avec différents ions métalliques en CoCl3-, CoCl4-, FeCl4- ou avec des halogénures covalents en BCl4-. Des composés complexes mixtes peuvent également être formés avec d'autres ligands tels que [Co(NH3)4Cl2]+.
En chimie organique, les composés chlorés sont également (parfois erronément) marqués avec le terme organochlorure. En particulier pour les composés couramment utilisés dans l'industrie comme le chlorure de vinyle (chloroéthylène), le chlorure de méthyle (chlorométhane) et le chlorure de méthylène (dichlorométhane), ces noms obsolètes restent têtus.
L'ion chlorure est l'ion chargé négativement Cl-. Il existe quand un atome neutre de l'élément chlore prend un électron. Il a une masse moléculaire d'environ 35,453 u. Les chlorures ont des points de fusion et d'ébullition très élevés.
Fondus ou dissous dans l'eau H2O (eau pure), les chlorures sont de bons conducteurs électriques.
Les chlorures solubles précipitent de la solution acide en présence de nitrate d'argent formant un solide pâle de chlorure d'argent. Le précipité est dissous dans l'ammoniaque et re-précipité par acidification avec de l'acide nitrique.
Voir aussi les fluorures, les bromures, les iodures...
Le chlorure de potassium est aussi appelé le muriate de potasse.
Test des ions chlorure
Les chlorures sont considérés comme une substance indésirable car ils peuvent rouiller l'acier, même si une couche protectrice a été appliquée autour de cet acier car les chlorures aspirent la vapeur d'eau à travers la couche protectrice par osmose.
Un test commun pour vérifier la quantité de chlorures est l'utilisation du nitrate d'argent. En ajoutant du nitrate d'argent et de l'acide nitrique au mélange, une réaction entraîne la formation de chlorure d'argent. Cela provoque un trouble du mélange, qui peut devenir blanc laiteux. Par comparaison avec les résultats standards, on peut alors déterminer la quantité de chlorures.
Ces tests sont effectués, par exemple, après le prétraitement des surfaces en acier pour s'assurer que les revêtements qui doivent fournir une protection ne tombent pas en panne prématurément par des cloques osmotiques. Cela intervient, par exemple, sur la coque des navires, dans des réservoirs ou dans du béton pour s'assurer que les excès de chlorures n'érodent pas prématurément le renforcement.
Les chlorures inorganiques
Les chlorures inorganiques contiennent l'anion Cl- et sont donc des sels d'acide chlorhydrique (HCl). Il est généralement traité avec des substances solides incolores à haut point de fusion.
Dans certains cas, la liaison avec le métal peut avoir un certain caractère covalent. Ceci est noté par exemple dans le chlorure de mercure (II) (HgCl2) qui se sublime à des températures assez basses. C'est pourquoi ce sel était autrefois connu sous le nom de "sublimato".
Le chlorure de fer (III) (FeCl3) présente également un certain caractère covalent. Ainsi, il peut être extrait d'une solution à forte concentration de chlorure avec de l'éther et sans la présence d'eau de cristallisation sublime à haute température.
La plupart des chlorures, à l'exception principalement du chlorure de mercure (I) (Hg2Cl2), du chlorure d'argent (AgCl) et du chlorure de thallium (I) (TlCl) sont très solubles dans l'eau.
En présence d'oxydants forts (permanganate, bismuth, peroxyde d'hydrogène, hypochlorite, etc.), les chlorures peuvent être oxydés en chlore élémentaire. Cette oxydation peut également être réalisée par électrolyse. En effet, l'électrolyse du chlorure de sodium en solution est la méthode la plus utilisée pour obtenir cet élément en plus de l'hydroxyde de sodium.
Les chlorures organiques
Dans les chlorures organiques, le chlore est directement attaché à un atome de carbone, la base d'un composé organique. La liaison est covalente, mais en raison de la différence d'électronégativité entre les deux éléments, elle est fortement polarisée. Pour cette raison, le chlore peut être substitué dans de nombreux cas dans des réactions de substitution nucléophiles.
Les chlorures organiques sont moins inflammables que les hydrocarbures correspondants. Ils sont aussi souvent plus toxiques. Certains chloroalcanes, tels que le dichlorométhane, sont importants en tant que solvants. Les insecticides tels que le lindane ou le DDT sont également des chlorures organiques. Dans ce groupe sont également les chlorodibenzodioxines qui sont devenus célèbres et redoutés par l'accident de Seveso.
Les chlorures des composés aliphatiques peuvent être obtenus par réaction directe de la substance avec le chlore élémentaire. La réaction a tendance à être violente et passe par un mécanisme radical peu sélectif.
La sélectivité peut être augmentée en utilisant à la place du chlore élémentaire N-chlorosucimide.
Il est généralement préférable de transformer un autre groupe fonctionnel en chlorure. Ainsi, les groupes hydroxy peuvent être substitués par un chlorure en appliquant de l'acide chlorhydrique (éventuellement en présence de chlorure de zinc comme catalyseur), du chlorure de thiényle, du chlorure de phosphore, etc.
Ils peuvent également être obtenus par addition de chlore ou d'acide chlorhydrique à des liaisons multiples d'alcènes ou d'alcynes. L'addition d'acide chlorhydrique donne principalement le produit Markownikov (avec le chlore attaché au carbone le plus substitué) dans des conditions polaires et le produit anti-Markownikov (avec le chlorure sur le carbone moins substitué) dans des conditions radicalaires.
Enfin, les chlorures aromatiques sont généralement obtenus par chloration directe dans une réaction de substitution électrophile en présence d'un acide de Lewis comme catalyseur.
Pour déterminer la présence de chlorure dans un composé organique, un fil de cuivre est chauffé dans une flamme bleue d'un bec Bunsen jusqu'à ce qu'aucune coloration marquée ne soit remarquée. Ensuite, il est mis en contact avec le composé organique et le composé est introduit avec le fil dans la flamme. Une couleur vert bleuâtre indique la présence de chlorure.
Les chlorures naturels
Dans la nature, il y a peu de chlorures organiques. Par conséquent, les chlorures organiques ont tendance à avoir une faible biodégradabilité et restent dans l'environnement pendant des années. En raison de leur nature hydrophobe, ils s'accumulent dans les graisses, en particulier dans les derniers maillons de la chaîne alimentaire et peuvent causer des problèmes de santé, ce qui rend les chlorures très importants pour la santé des gens.
Synonymes, antonymes
Voir tous les synonymes pour "chlorure".2 synonymes (sens proche) de "chlorure" :
- chlorhydrate
- muriate
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à CHLORURE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot CHLORURE est dans la page 4 des mots en C du lexique du dictionnaire.
En rapport avec "chlorure"

Le chlorure de potassium (KCl) est la source de potassium (sel chlorure) la plus utilisée en agriculture, présent dans environ 95 % de tous les engrais...
Le chlorure de sodium est le sel de table de formule chimique NaCl, représentant un rapport 1 :1 d'ions sodium et chlore.
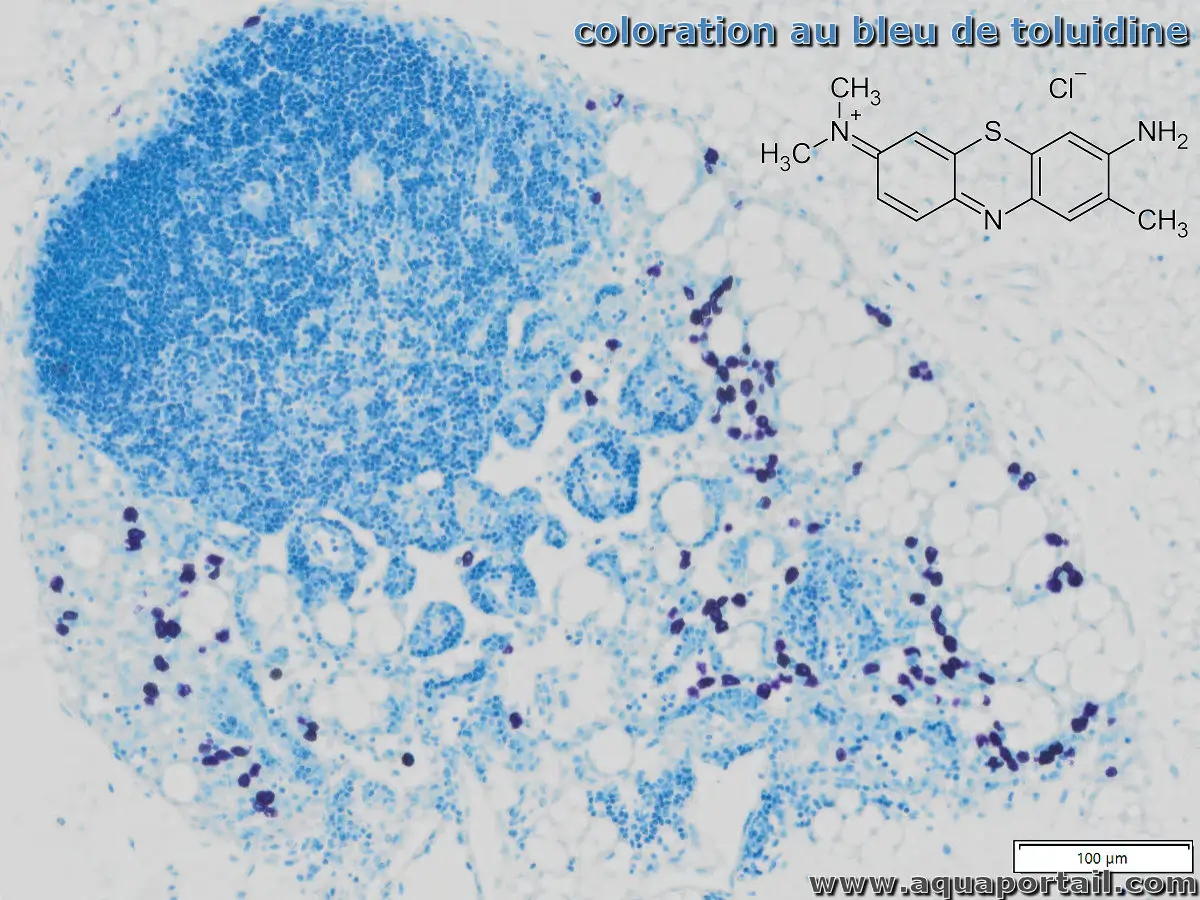
Le bleu de toluidine est un colorant très voisin du bleu de méthylène, qui confère une couleur rouge à certains éléments et bleue à d'autres.

Le muriate de potasse est du chlorure de potassium qui est un dérivé de l'acide muriatique (muriate barotique), l'ancien nom de l'acide chlorhydrique.
