PDH
Définition
PDH est le sigle et l'acronyme de pyruvate déshydrogénase. Elle est le premier composant du complexe enzymatique pyruvate déshydrogénase, le PDC formé de trois types de pyruvates déshydrogénases. Dans les trois types, la fonction est d'effectuer la décarboxylation oxydative du pyruvate en acétate, en libérant du dioxyde de carbone.
Chaînes humaines PDH alpha et bêta :
Le PDH (pyruvate déshydrogénase) des chaînes alpha et bêta humaines. Chez l'homme, il existe trois gènes codant pour la PDH : PDHA1, PDHA2 et PDHA3. L'enzyme est formée en formant des tétramères de deux unités alpha et deux unités bêta. Son emplacement cellulaire est la matrice mitochondriale.
Explications
Une pyruvate déshydrogénases (PDH) représente une pierre angulaire du métabolisme énergétique cellulaire, liant la glycolyse et le métabolisme des acides aminés à chaîne ramifiée au cycle de l'acide citrique et à la lipogenèse.
Types de pyruvate déshydrogénase
Les 3 types de pyruvate déshydrogénase reconnus à ce jour sont :
- Pyruvate déshydrogénase de transfert d'acétyle ou PDH : cette enzyme catalyse la réaction de décarboxylation oxydative du pyruvate en utilisant le thiamine diphosphate comme cofacteur; elle fait partie du complexe multienzymatique pyruvate déshydrogénase (PDC) étant l'unité E1 de celui-ci. Les autres composants du complexe sont la dihydrolipoyl-lysine-résidu acétyltransférase (DLAT) et la dihydrolipoyl-déshydrogénase (DLD) en tant que composants E2 et E3 respectivement.
- Pyruvate déshydrogénase NADP+: cette enzyme catalyse la réaction de décarboxylation oxydante du pyruvate; elle est inhibée par l'oxygène et stimulée par l'insuline. Elle est présentée comme un homodimère et se lie à une molécule de FAD, à une molécule de FMN et au pyrophosphate de thiamine.
- Pyruvate déshydrogénase cytochrome : catalyse aussi la réaction de décarboxylation oxydante du pyruvate (selon une autre équation); cette enzyme bactérienne qui se présente comme un homotétramère auquel est attachée une molécule de FAD, une molécule de thiamine pyrophosphate et un ion magnésium. Sa localisation cellulaire est la membrane cellulaire et est activée par une digestion protéolytique limitée.
Rôles et fonctions
La pyruvate déshydrogénase (PDH) catalyse une étape métabolique irréversible et sans retour car son substrat pyruvate est gluconéogène ou anaplérotique, alors que son produit l'acétyl-CoA ne l'est pas. Le contrôle de son activité est complexe et implique un contrôle par ses substrats et produits, une modification covalente par (dé)phosphorylation et une adaptation à long terme.
La PDH est rétro-inhibée par ses produits et est inactivée par phosphorylation de trois résidus sérine dans la sous-unité alpha de E1, l'un des trois composants du complexe PDH. Quatre PDH kinases (PDK) différentes sont connues. La phosphorylation du site 1 par toutes les PDK est inactivante, PDK2 étant la kinase la plus active sur ce site.
La phosphorylation du site 2 (principalement par PDK4) et du site 3 (par PDK1 uniquement) introduit un contrôle hiérarchique en retardant la déphosphorylation du site 1, maintenant ainsi la PDH dans son état inactif. Cela devrait intervenir dans le coeur, qui exprime PDK1 au-dessus des autres PDK. De plus, les substrats et produits PDH contrôlent également l'activité PDK.
Le pyruvate inhibe, tandis que l'acétyl-CoA stimule, la PDK. Cependant, l'insensibilité relative de PDK4 au pyruvate maintient la PDH cardiaque dans son état phosphorylé inactif, après une privation prolongée. De plus, la régulation à la hausse de la PDK en réponse à un régime riche en graisses, à la famine ou à une carence en insuline, maintient l'oxydation du glucose à un faible niveau, tandis que l'oxydation des acides gras est augmentée, imitant ainsi "l'inflexibilité métabolique", une caractéristique métabolique caractéristique de la résistance à l'insuline.
À l'inverse, la glycémie chez les souris déficientes en PDK4 affamées est plus faible que chez les témoins, probablement parce que la PDH active détourne le pyruvate, un substrat néoglucogénique, en acétyl-CoA. Ces résultats soulignent le rôle central de la PDH dans le contrôle du métabolisme du glucose et des lipides.
Régulation chez les mammifères
La régulation de la PDH chez les mammifères intègre efficacement le métabolisme intermédiaire du glucose, des acides aminés et des lipides dans une variété d'états nutritionnels et physiologiques. Par exemple, la suppression de l'activité de la PDH survient lors de l'ingestion d'un régime riche en graisses/faible teneur en glucides ou pendant la famine, qui conserve les composés précurseurs (pyruvate, lactate et alanine) qui sont utilisés pour synthétiser le glucose et qui font dépendre la plupart des tissus du corps sur les acides gras ou les cétones pour le carburant.
Cela épargne l'apport limité de glucose pour une utilisation préférentielle par les tissus neuronaux, y compris le cerveau. Inversement, le mouvement musculaire et l'augmentation du débit cardiaque pendant l'exercice nécessitent l'activation du complexe PDH, tout comme la biosynthèse des acides gras ou des stérols, qui utilisent l'acétyl-CoA comme substrat.
Le dysfonctionnement de la PDH a longtemps été apprécié dans la maladie du sirop d'érable, l'acidose lactique et la cirrhose biliaire primitive ainsi que, plus récemment, dans le diabète, le cancer, les maladies cardiaques et la neurodégénérescence. L'étiologie de bon nombre de ces maladies résulte de mutations génétiques spécifiques dans E1, E2 ou E3, tandis que d'autres résultent d'un contrôle régulateur anormal de la PDH par les kinases et les phosphatases.
Synonymes, antonymes
Voir tous les synonymes pour "PDH".1 synonyme (sens proche) de "pDH" :
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à PDH sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot PDH est dans la page 2 des mots en P du lexique du dictionnaire.
Mots en P à proximité
pavimenteux paxille paxilline paysage PDGFPDHPearlScale peau peau de chamois pêche à pied pêche artisanale
En rapport avec "PDH"
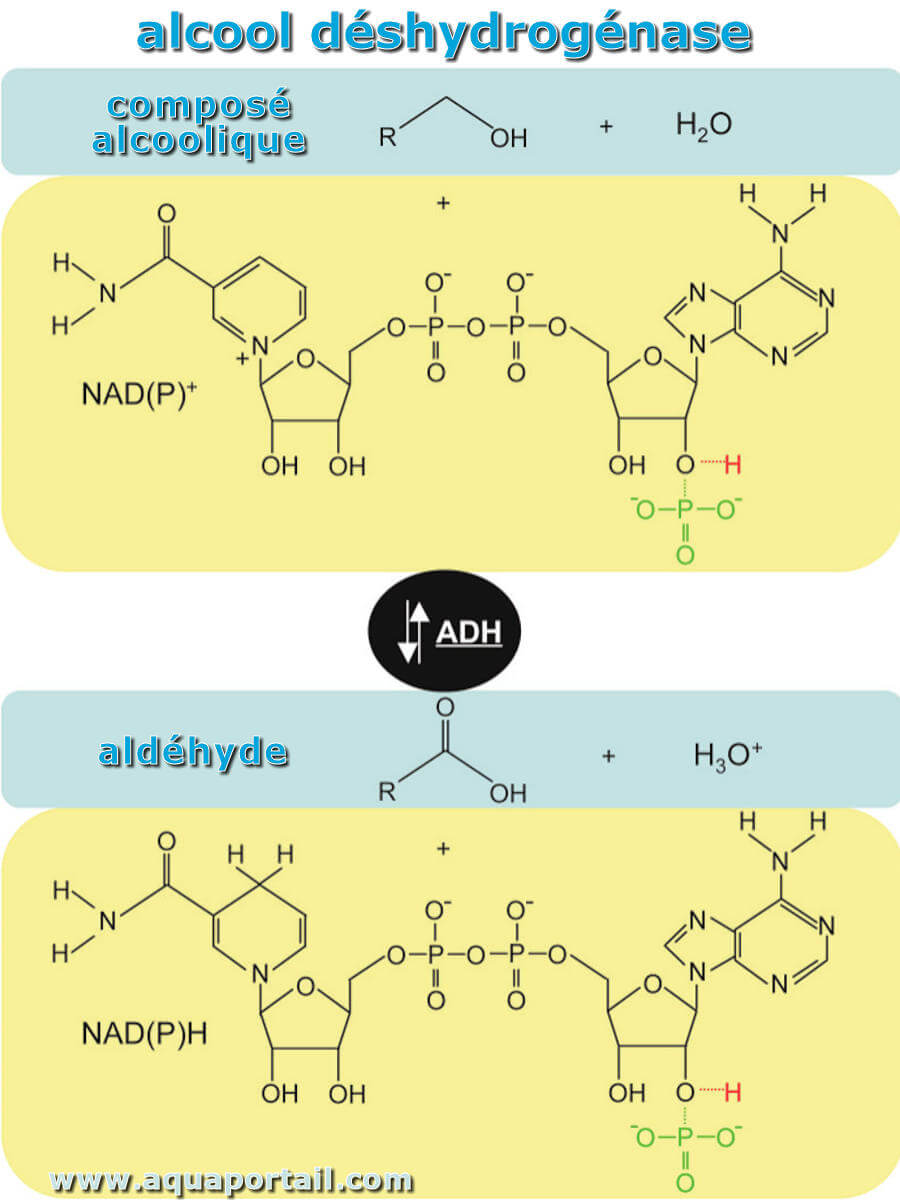
L'alcool déshydrogénase (ADH) est une enzyme protéique de type déshydrogénase que les organismes vivants ont développé pour faire face aux substrats...
La déshydrogénase est une enzyme de déshydrogénation de la classe des oxydoréductases qui catalyse la perte d'un hydrogène.
glycéraldéhyde-3-phosphate déshydrogénase
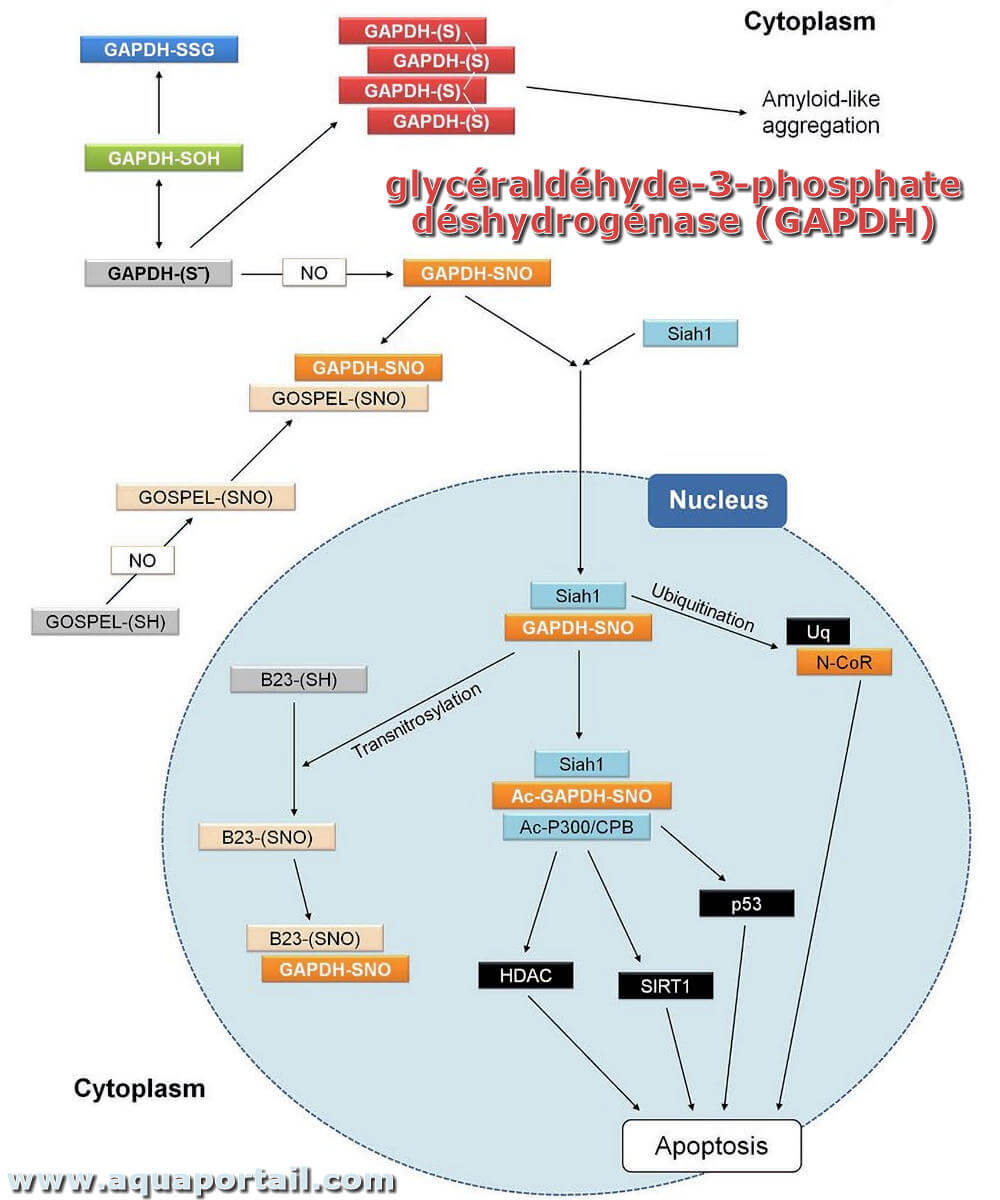
La GAPDH ou glycéraldéhyde-3-phosphate déshydrogénase (EC 1. 2.1. 12) est une enzyme catalysant une étape de la glycolyse (ou cycle de Krebs) et aboutissant...

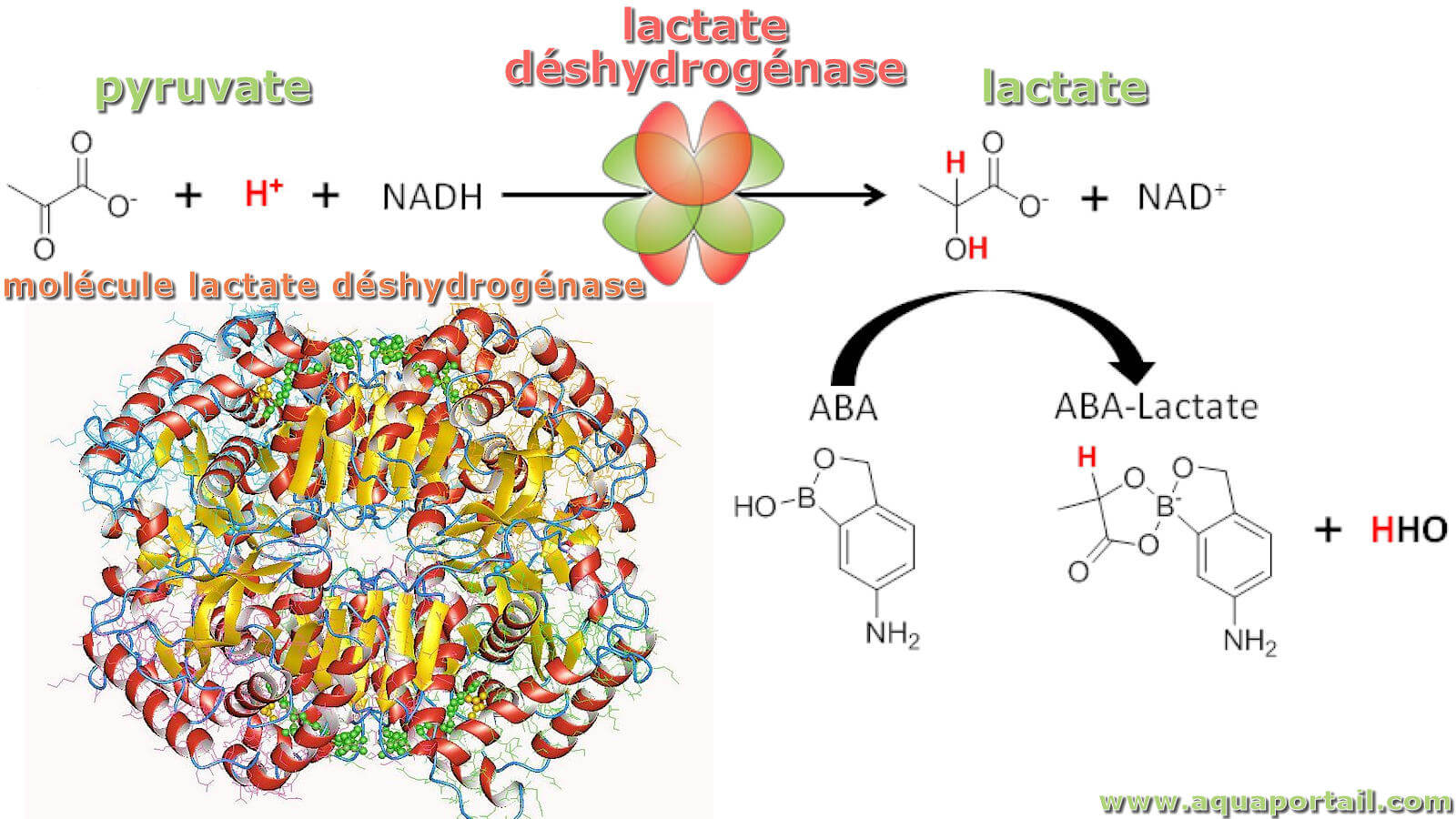
La lactate déshydrogénase distingue une enzyme à NAD de la classe des hydrolases qui catalyse la réduction du lactate en pyruvate en anaérobiose.
