PH du sol
Définition
Le pH du sol est une mesure de l'acidité ou de l'alcalinité des sols. Le pH du sol est considéré comme l'une des principales variables dans les sols, car il contrôle de nombreux processus chimiques qui se déroulent dans ce sol. Ce potentiel hydrogène affecte spécifiquement la disponibilité des éléments nutritifs des plantes, en contrôlant les formes chimiques des nutriments.
Le pH du sol au niveau mondial :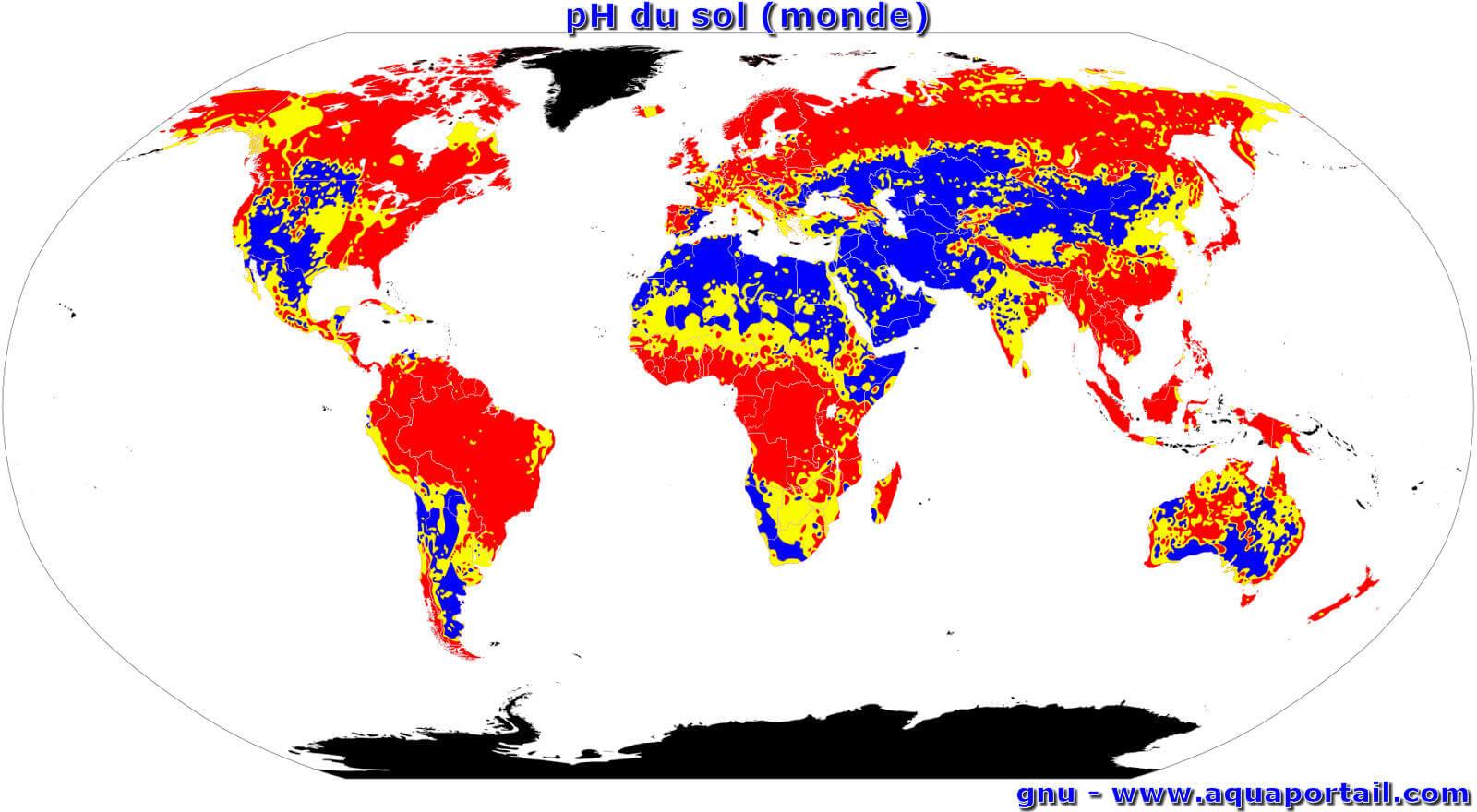
Les variations mondiales du pH du sol vont du sol acide (rouge), au sol neutre (jaune) puis au sol alcalin (basique, bleu). Les zones noires restent sans données.
Explications
La plage de pH du sol optimale pour la plupart des plantes terrestres varie de 5,5 à 7,5 mais de nombreuses plantes se sont adaptées à des valeurs de pH en dehors de cette plage. Le pH (ou potentiel Hydrogène) est défini comme l'activité négative logarithmique (base 10) des ions hydronium (H+ ou plus précisément H3O+) dans une solution. L'indice varie de 1 à 14, 7 étant neutre. Un pH inférieur à 7 est acide et supérieur à 7 est basique (alcalin).
Le terme pH du sol est une composition de sol et de pH. Il est une mesure de l'activité des protons H+ dans l'eau du sol et sont influencés par les tampons naturels, en particulier par la matière organique morte du sol en décomposition.
Mesure
Le pH du sol est mesuré dans une suspension de sol dans une solution tampon de pH neutre contenant du pH ou du chlorure de calcium ou du chlorure de potassium. Dans ce cas, les ions H+ adsorbés sur les échangeurs étant déplacés par les ions KCl ou CaCl2, le pH ainsi mesuré est d'environ 0,3 à 1,0 unité en dessous du pH mesuré dans des suspensions aqueuses. Cependant, toutes les informations de la littérature ne sont pas corrigées en conséquence.
Classification des plages de pH du sol
Le Service de conservation des ressources naturelles classe les plages de pH du sol comme suit :
| Dénomination | Gamme pH |
|---|---|
| Ultra acide | < 3,5 |
| Extrêmement acide | 3,5–4,4 |
| Très fortement acide | 4,5–5,0 |
| Fortement acide | 5,1–5,5 |
| Modérément acide | 5,6–6,0 |
| Légèrement acide | 6,1–6,5 |
| Neutre | 6,6–7,3 |
| Légèrement alcalin | 7,4–7,8 |
| Modérément alcalin | 7,9–8,4 |
| Fortement alcalin | 8,5–9,0 |
| Très fortement alcalin | > 9,0 |
Solubilité des minéraux en fonction du pH du sol
Les zones de grande solubilité de divers minéraux dans l'eau du sol en fonction du pH du sol. Ces zones sont sujettes à la lixiviation (toxique) des minéraux dissous par la pluie ou l'irrigation dans les eaux souterraines, ainsi qu'à la pollution des eaux souterraines par les nitrates, à la fertilisation excessive et à la capacité d'échange de cations.
L'érosion des sols sur des surfaces de sol non protégées et le manque de végétation, par exemple : lorsque les champs sont labourés dans de bonnes pratiques professionnelles ou exposés trop longtemps, entraînent une perte d'humus et de sédiments, des effets trop dommageables. Le vent et l'eau courante (pluie) remplaceront le sol fertile et seront transportés hors du champ, réduisant ainsi la capacité tampon et de champ (capacité de stockage de l'eau) du sol. La dégradation des sols est la conséquence, la sécheresse et le manque de pluie ont un impact négatif sur la production et les revenus.
Les valeurs de pH suivantes sont enregistrées pour les sols cultivés sains typiques :
- 5,0 à 5,5 à < 4 % de matière organique et < 5 % d'argile,
- 5,4 à 6,0 à 5 à 12 % d'argile,
- 6,0 à 6,5 > à 13 % d'argile.
La majorité des cultures se développent sur des sols neutres ou légèrement acides. Certaines plantes se développent sur des sols plus acides, tels que les pommes de terre et les fraises. Le chou et les autres plantes prospèrent sur les sols alcalins. L'apport de sol acide provenant des précipitations ou des émissions peut être partiellement amorti par les fonctions tampons du sol, en particulier l'humus. Le sol acide peut être neutralisé en chaulant et en ajoutant de l'humus ou du compost.
Les sols trop alcalins peuvent être amenés à un pH neutre par l'entrée de tourbe riche en acide humique, en ammonium (par exemple, contenu dans le fumier) et en litière de conifères. Un environnement de sol fortement acide est particulièrement critique, car de fortes concentrations d'aluminium peuvent être dissoutes. Les sols très basiques peuvent souffrir d'un manque de manganèse dissous librement. En général, une augmentation de pH basique entraîne une amélioration structurelle.
Sources d'acidité du sol
L'acidité dans les sols provient des ions H+ et Al3+ dans la solution du sol et est adsorbée à la surface du sol. Alors que le pH est la mesure de H+ en solution, Al3+ est important dans les sols acides, car entre pH 4 et 6, Al3+ réagit avec l'eau H2O pour former AlOH2+ et Al(OH)2+, avec libération d'ions H+ supplémentaires. Chaque ion Al3+ peut créer 3 ions H+.
De nombreux autres processus contribuent à la formation de sols acides tels que les précipitations, l'utilisation d'engrais, l'activité radiculaire de la plante et l'altération des minéraux primaires et secondaires dans le sol. Les sols acides peuvent également être causés par des polluants tels que les pluies acides et les eaux de ruissellement provenant des mines.
Voir aussi les sols sulfatés acides.
Les principales causent affectant le ph d'un sol sont :
- Précipitations : Les sols acides se trouvent plus fréquemment dans les zones de fortes précipitations. Des précipitations excessives lessivent la base de cations du sol, augmentant le pourcentage de Al3+ et de H+ par rapport aux autres cations. De plus, l'eau de pluie a un pH légèrement acide de 5,7, dû à une réaction avec le CO2 dans l'atmosphère qui forme de l'acide carbonique.
- Utilisation d'engrais : Les engrais à base d'ammonium (NH4+) réagissent dans le sol dans un processus appelé nitrification pour former du nitrate (NO3-) et, dans le processus, libèrent des ions H+.
- Activité des racines des plantes : Les plantes absorbent les nutriments sous forme d'ions (NO3-, NH4+, Ca2+, H2PO4-, etc.) et occupent souvent plus de cations que les anions. Cependant, les plantes doivent maintenir une charge neutre sur leurs racines. Afin de compenser le coût supplémentaire positif, des ions H+ provenant de la racine seront disponibles. Certaines plantes exhalent également des acides organiques dans le sol pour acidifier la zone autour de leurs racines pour aider à solubiliser les nutriments métalliques insolubles à pH neutre, tels que le fer (Fe).
- météorisation des minéraux : les minéraux primaires et secondaires qui composent le sol contiennent de l'Al. Au fur et à mesure que le temps passe sur ces minéraux, certains composants tels que Mg, Ca et K sont absorbés par les plantes. le sol, mais en raison des propriétés chimiques, Fe et Al restent dans le profil du sol. Les sols fortement altérés sont souvent caractérisés par de fortes concentrations en oxydes de fer et de fer.
- Pluies acides : lorsque l'eau atmosphérique réagit avec les composés soufrés et azotés résultant des processus industriels, il peut en résulter la formation d'acide sulfurique et nitrique dans les eaux pluviales. Cependant, la quantité d'acidité déposée dans l'eau de pluie est bien moindre, en moyenne, que celle créée par les activités agricoles.
- déchets miniers : Des conditions extrêmement acides peuvent se former dans les sols à proximité des déchets miniers en raison de l'oxydation de la pyrite.
- Décomposition de la matière organique par les microorganismes libère du CO2 qui, mélangé à de l'eau dans le sol, forme de l'acide carbonique faible (H2CO3).
La gestion et la correction de l'acidité est assez facile.
Le matériau le plus couramment utilisé pour le chaulage des sols est la chaux agricole ou la calcite, qui contient principalement du carbonate de calcium (CaCO3). L'oxyde de calcium (CaO) connu sous le nom de chaux vive et d'hydroxyde de calcium [Ca(OH)2] connu sous le nom de chaux hydratée sont deux sources de réaction rapide dans le sous-sol, mais très difficiles et désagréables à manipuler. son utilisation est recommandée. D'autres sources telles que la dolomite (CaCO3.MgCO3) ont l'avantage de fournir du magnésium.
Sources d'alcalinité du sol
Les sols basiques ont une saturation élevée en cations acides (K+, Ca2+, Mg2+ et Na+). Cela est dû à une accumulation de sels solubles classés comme sol salin, sol sodique, sol salin-sodique ou sol alcalin. Tous les sols salins et sodiques ont de fortes concentrations en sel, les sols salins étant dominés par les sels de calcium et de magnésium et les sols de sodium étant dominés par le sodium. Les sols alcalins sont caractérisés par la présence de carbonates. Le sol dans les zones calcaires près de la surface est alcalin en raison du carbonate de calcium présent dans le calcaire en mélange constant avec le sol. Les sources d'eau souterraine dans ces zones contiennent du calcaire dissous.
Effet du pH du sol sur le développement des plantes
Les plantes qui poussent sur des sols acides peuvent présenter divers symptômes dont la toxicité de l'aluminium (Al), de l'hydrogène (H) et / ou du manganèse (Mn), ainsi que des carences potentielles en calcium (Ca) et magnésium (Mg).
La toxicité de l'aluminium est le problème le plus courant dans les sols acides. L'aluminium est présent dans tous les sols, mais s'il est dissous, Al3+ est toxique pour les plantes; Al3+, qui est plus soluble à faible pH, au-dessus de pH 5,2, l'aluminium est peu soluble dans la plupart des sols. L'aluminium n'est pas un nutriment pour les plantes et, en tant que tel, il n'est pas activement absorbé par les plantes, mais entre par les racines des plantes de manière passive par osmose. L'aluminium endommage les racines de plusieurs façons : à l'extrémité des racines, l'aluminium interfère avec l'absorption du calcium, un nutriment essentiel, et se lie au phosphate et interfère avec la production d'ATP et d'ADN, car ces derniers Ils contiennent du phosphate. L'aluminium peut également limiter l'expansion de la paroi cellulaire des racines, ce qui retarde la croissance.
Au-dessous d'un pH de 4, les ions H+ produisent eux-mêmes des dommages aux membranes cellulaires de la racine.
Dans les sols à forte teneur en minéraux de manganèse (Mn), la toxicité du manganèse peut devenir un problème à pH 5,6 ou moins. Le manganèse, comme l'aluminium, devient de plus en plus soluble sous forme de gouttes de pH et les symptômes de toxicité du manganèse peuvent être observés à un pH inférieur à 5,6. Le Mn est un nutriment essentiel pour les plantes, de sorte que le transport du manganèse apparaît dans les feuilles des plantes. Les symptômes classiques de la toxicité du manganèse peuvent être l'apparition de feuilles rugueuses ou venteuses.
Voir aussi l'ammoniac, la volatilisation, la volatilisation de l'ammoniac et la biovolatilisation.
Synonymes, antonymes
Voir tous les synonymes pour "pH du sol".0 synonyme (sens proche) pour "pH du sol".
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à PH DU SOL sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
L'expression PH DU SOL est dans la page 3 des mots en P du lexique du dictionnaire.
Mots en P à proximité
pétrole Pétromyzontides peuplement pH baisse pH de l'eau pH du solphacéloïde phage phage tempéré phage transducteur phage virulent
En rapport avec "pH du sol"

Une acidité, une alcalinité, est une force d'un acide ou d'une base : les propriétés acides (ou basiques = alcalines) d'une solution sont dues aux ions H⁺...
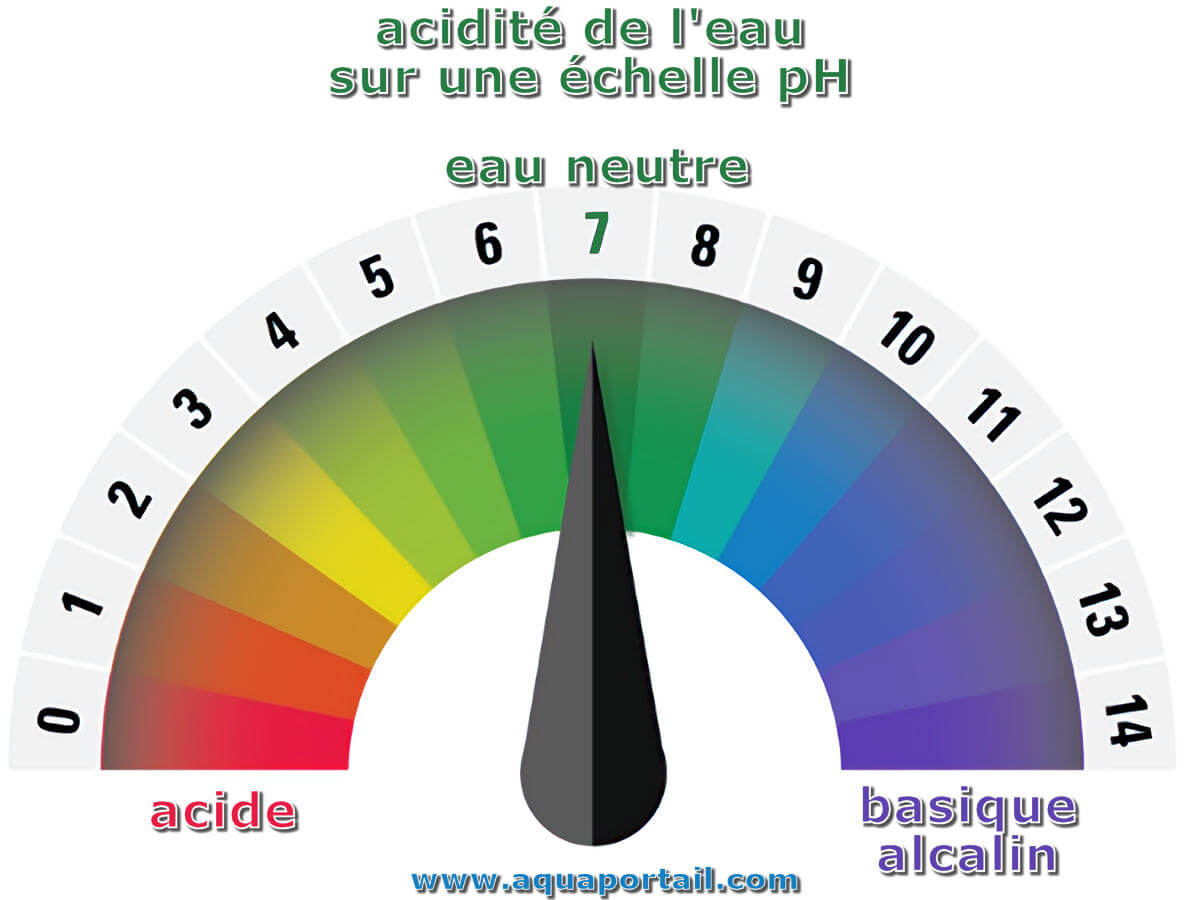
L'acidité de l'eau est une quantité, exprimée en milliéquivalents par litre d'eau, de base forte qui doit être utilisée pour neutraliser les acides forts...
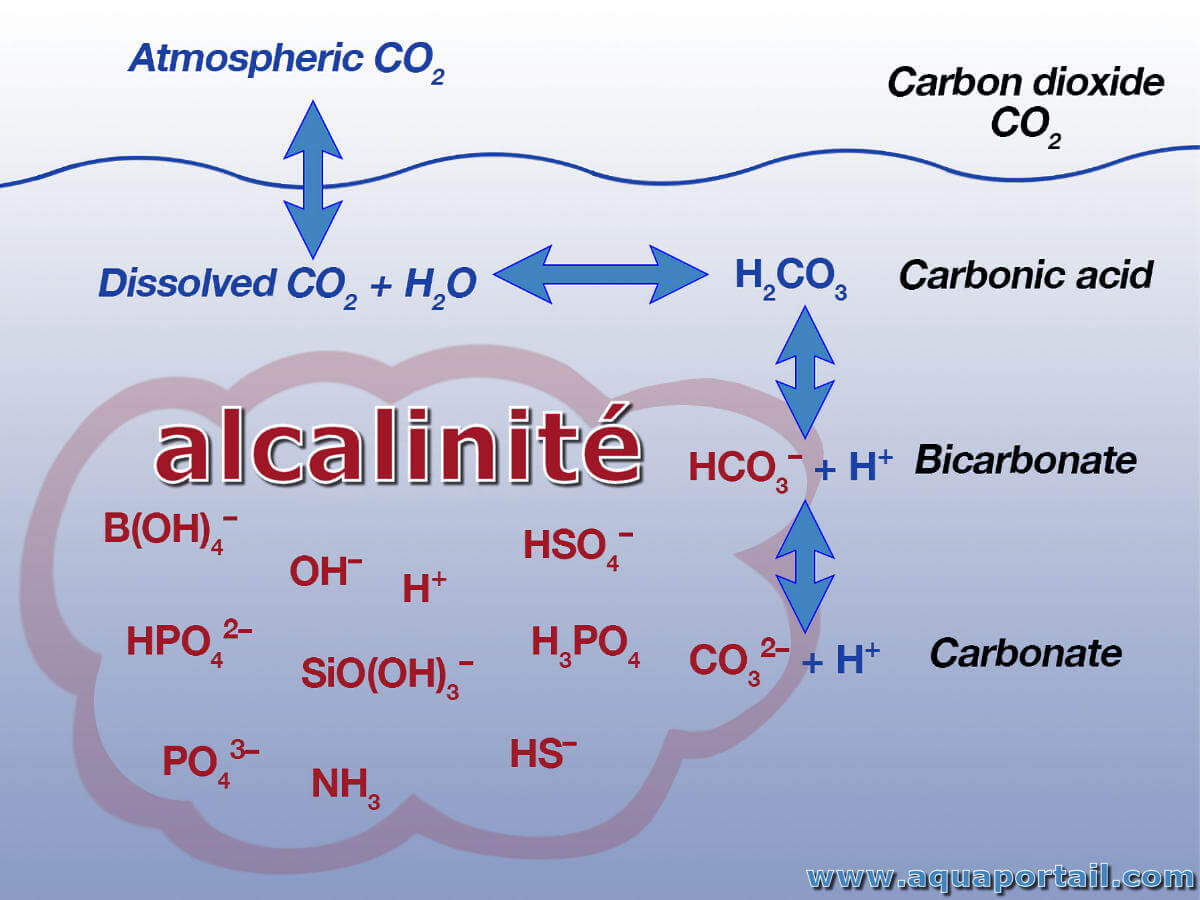
L'alcalinité est la capacité d'une solution minérale pour neutraliser les ions d'hydrogène; généralement exprimée en équivalent de carbonate de calcium.
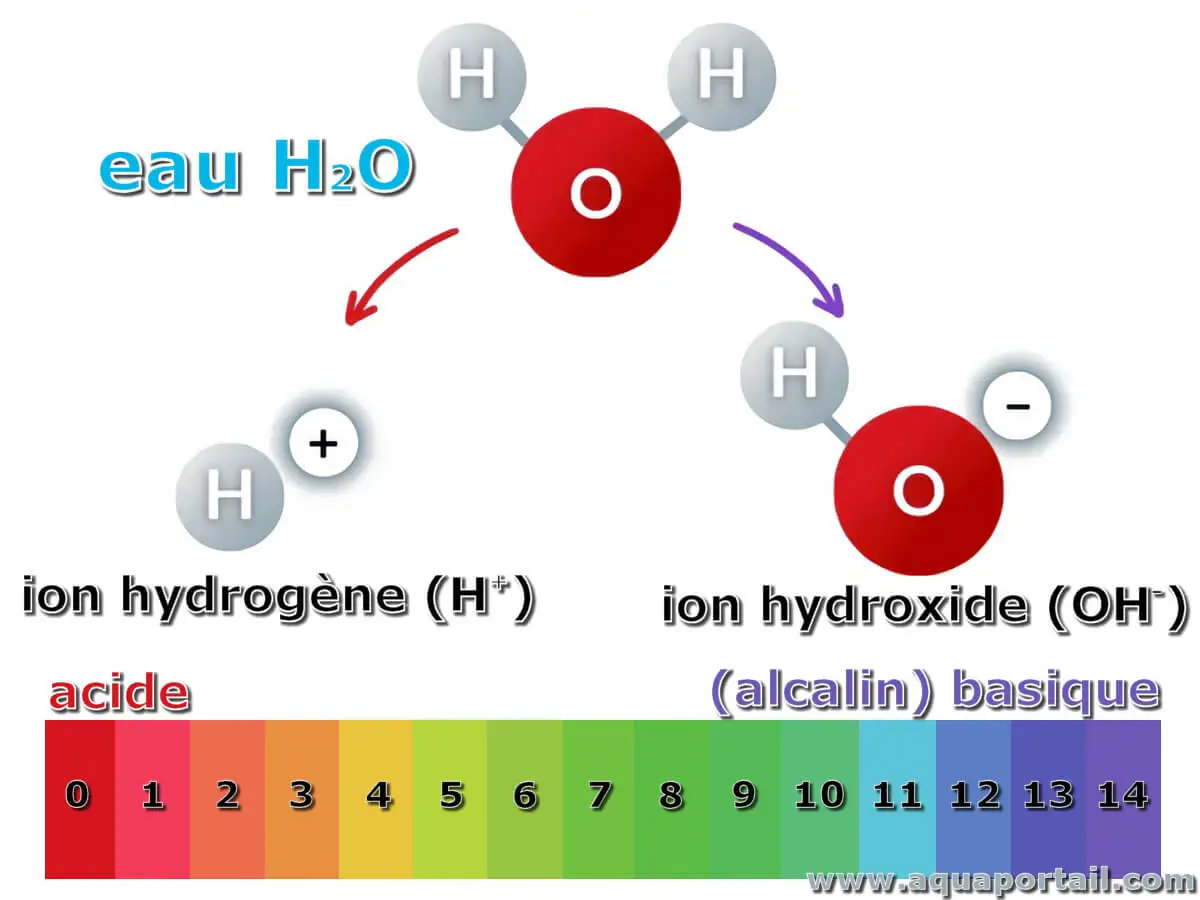
L'alcalinité de l'eau est la capacité de l'eau à neutraliser les acides ou à résister aux changements qui provoquent l'acidité, en maintenant un pH stable.
