Alcalinité de l'eau
Définition
L'alcalinité de l'eau est la capacité de l'eau à neutraliser les acides ou à résister aux changements qui provoquent l'acidité, en maintenant un pH stable. Le titrage est utilisé pour mesurer l'alcalinité d'un échantillon d'eau, et l'eau avec un pH de 7,2 ou plus est considérée comme alcaline. Les sols et la géologie ont la plus grande influence sur le pH et l'alcalinité de l'eau.
L'alcalinité de l'eau :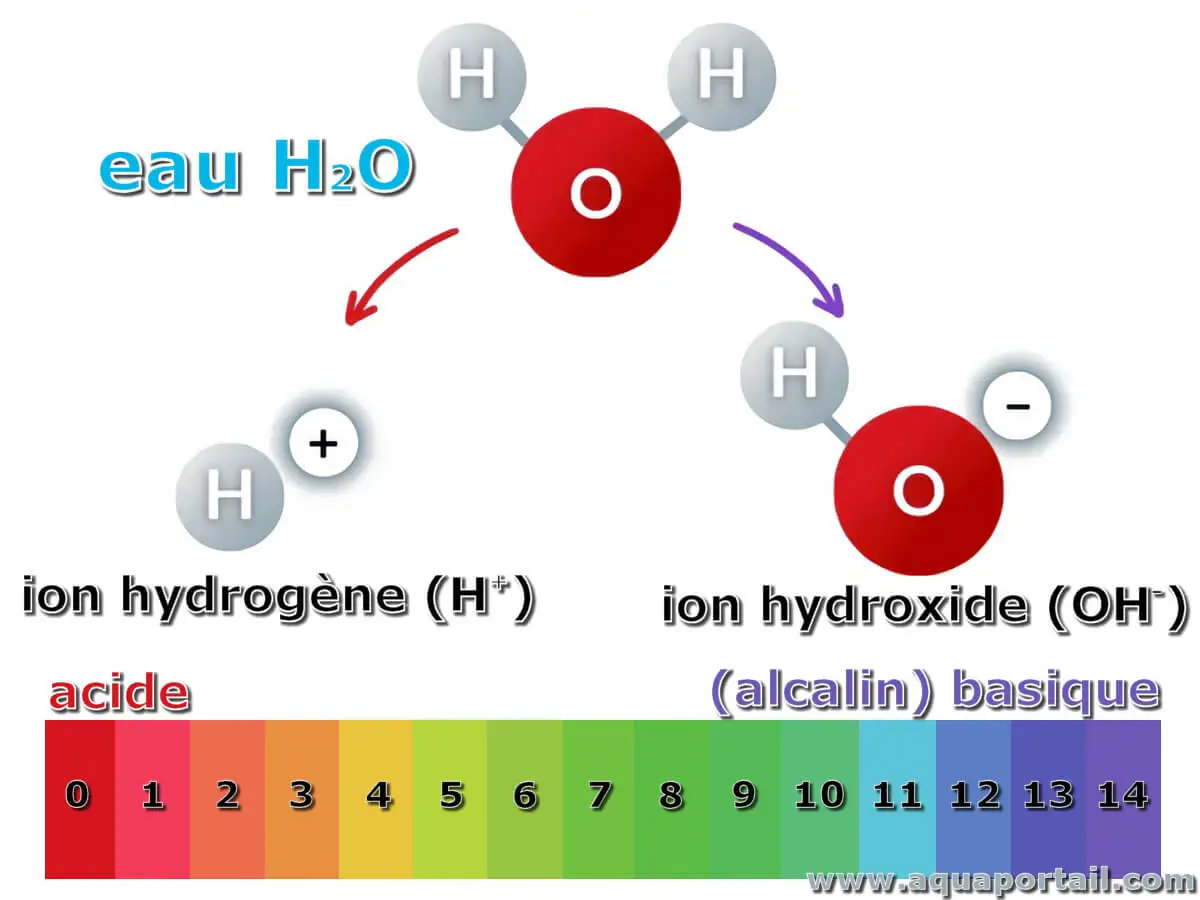
L'alcalinité de l'eau est une mesure de l'excès d'accepteurs de protons (bases et acides faibles qui peuvent réagir avec les acides plus forts et les neutraliser en acceptant H+ comme ion par rapport aux ions H+ et aux acides forts qui peuvent donner des protons dans des réactions de neutralisation.
Explications
L'alcalinité est une mesure de la présence de constituants bicarbonate, carbonate ou hydroxyde. Des concentrations inférieures à 100 ppm sont souhaitables pour l'approvisionnement en eau domestique. La plage recommandée pour l'eau potable est de 30 à 400 ppm.
Qualité de l'eau, hygiène et santé
Une alcalinité élevée donne un goût amer à l'eau. Cependant, la principale préoccupation concernant l'alcalinité de l'eau est liée aux réactions qui peuvent intervenir entre l'alcalinité et certains cations dans l'eau. Les sédiments qui en résultent peuvent entraîner l'obstruction des canalisations et d'autres accessoires du réseau d'approvisionnement en eau.
Les mesures d'alcalinité de l'eau sont généralement effectuées lors de l'analyse des eaux naturelles pour déterminer leur pouvoir tampon. Ces mesures sont également fréquemment utilisées comme variable de contrôle de processus dans le traitement de l'eau et des eaux usées. Les valeurs maximales d'alcalinité pour l'eau potable ou les effluents d'eaux usées sont variables selon les législations des pays.
Eaux souterraines
L'alcalinité est une mesure de la capacité de neutralisation des acides de l'eau et est généralement déterminée par titrage contre l'acide sulfurique jusqu'au point final de la réaction acido-basique. Dans les eaux souterraines, les espèces de carbonate prédominent et un point final d'environ 4,5 marque la consommation de bicarbonate en solution. Le point final peut être déterminé à l'aide d'un colorant indicateur, tel que le vert de bromocrésol, ou le pH peut être surveillé et l'inflexion de la courbe de titrage identifiée.
Dans les eaux relativement rares où le pH est élevé, la courbe de titrage peut également indiquer une inflexion due à la présence de carbonate. Dans certaines eaux, d'autres acides faibles, tels que le borate, le silicate et les acides organiques, peuvent également contribuer à l'alcalinité.
Les mesures d'alcalinité sont souvent effectuées sur place mais ne sont parfois pas considérées comme aussi critiques que le pH, car la perte de CO2 ne modifie pas en soi l'alcalinité. Cependant, plusieurs chercheurs ont constaté que des erreurs importantes étaient introduites par l'utilisation de données de laboratoire plutôt que de données in situ.
Cela dit, il est possible que des échantillonneurs inexpérimentés identifient par erreur le point final du titrage sur le terrain, et il est toujours recommandé de déterminer également l'alcalinité en laboratoire. Pendant le stockage, il peut y avoir une activité biologique qui modifie l'alcalinité ou une perte extrême de CO2 peut entraîner une précipitation de CaCO3 dans le flacon d'échantillon. Dans les terrains carbonatés, il peut être nécessaire de filtrer l'échantillon d'alcalinité car il peut y avoir des particules de calcite en suspension conduisant à une surestimation de la valeur. Pour certains échantillons fortement contaminés, un point final stable peut ne pas être obtenu s'il y a un équilibre avec une phase solide.
Eau de mer
Les principaux accepteurs de protons dans l'eau de mer sont les ions bicarbonate et carbonate, et le borate (B(OH)4-). Une expression simple pour l'alcalinité totale, excluant les espèces moins abondantes, est donnée par Zeebe et Wolf-Gladrow : AT = [HCO3-] + 2[CO32-] + [B(OH)4-] + [OH-] - [H+].
SBV allemand
SBV est une abréviation du terme allemand "Säurebindungsvermögen" désignant la teneur en réserves alcalines ou alcalinité de l'eau. Sa détermination permet d'estimer cette dernière ainsi que la dureté temporaire de l'eau par une méthode simple (indicateur méthyl orange).
Les équivalences sont : 1 SBV = 50 mg éq. CaCO3/l = 28 mg éq. CaO/l = 20 mg Ca2+/l = 2,8 degrés allemand de dureté = 1 milliéquivalent/l.
Synonymes, antonymes
Voir tous les synonymes pour "alcalinité de l'eau".1 synonyme (sens proche) de "alcalinité de l'eau" :
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à ALCALINITÉ DE L'EAU sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
L'expression ALCALINITE DE L'EAU est dans la page 3 des mots en A du lexique du dictionnaire.
Mots en A à proximité
albuminée alcali réaction alcalin alcalinisation alcalinité alcalinité de l'eaualcalinité résiduelle calcite alcalinité totale alcalinophile alcalisation alcaloïde
En rapport avec "alcalinité de l'eau"
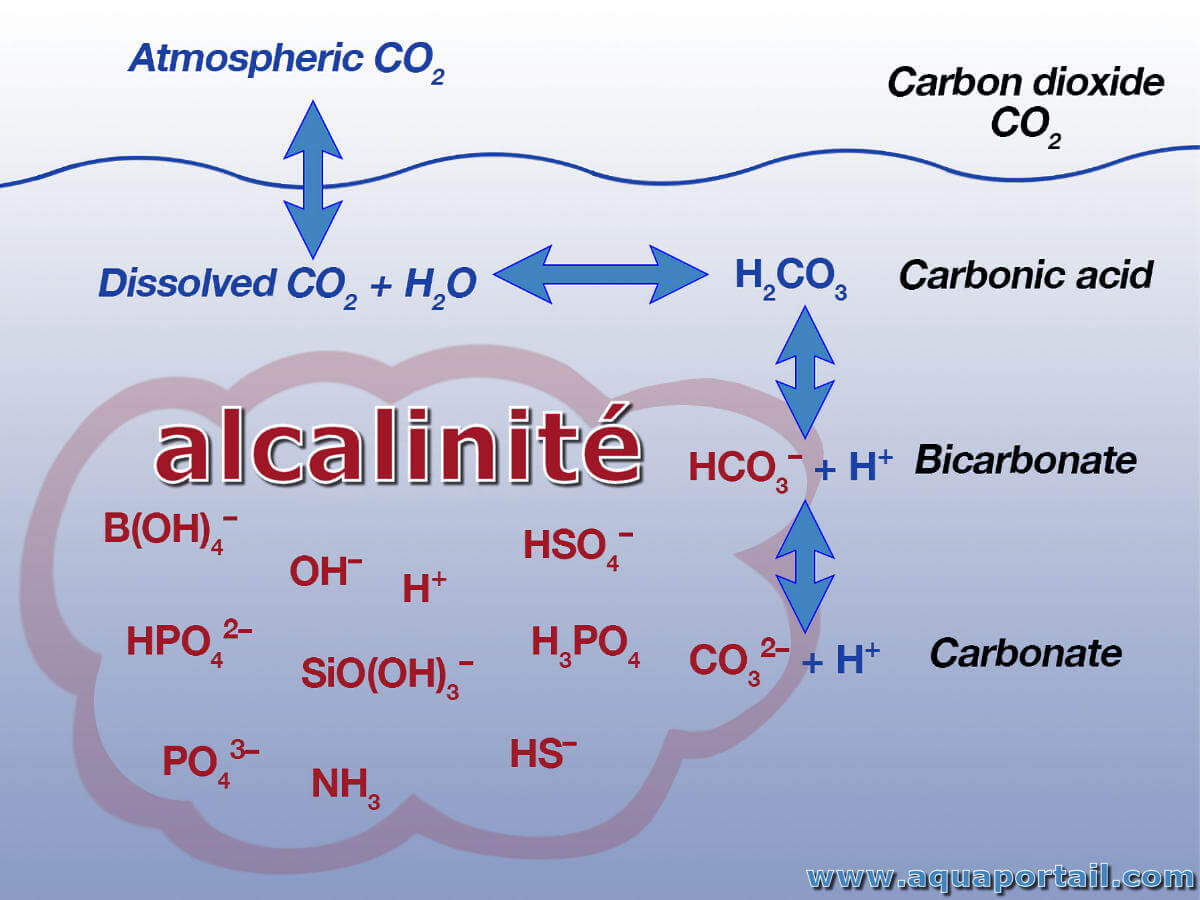
L'alcalinité est la capacité d'une solution minérale pour neutraliser les ions d'hydrogène; généralement exprimée en équivalent de carbonate de calcium.

Une alcalinité résiduelle calcite est un paramètre qui exprime la différence entre les moles charge de carbonates et celles de calcium.

L'alcalinité totale, parmi toutes les formes d'alcalinités, correspond à la concentration totale de l'eau en bases, exprimée en milligrammes par litre...
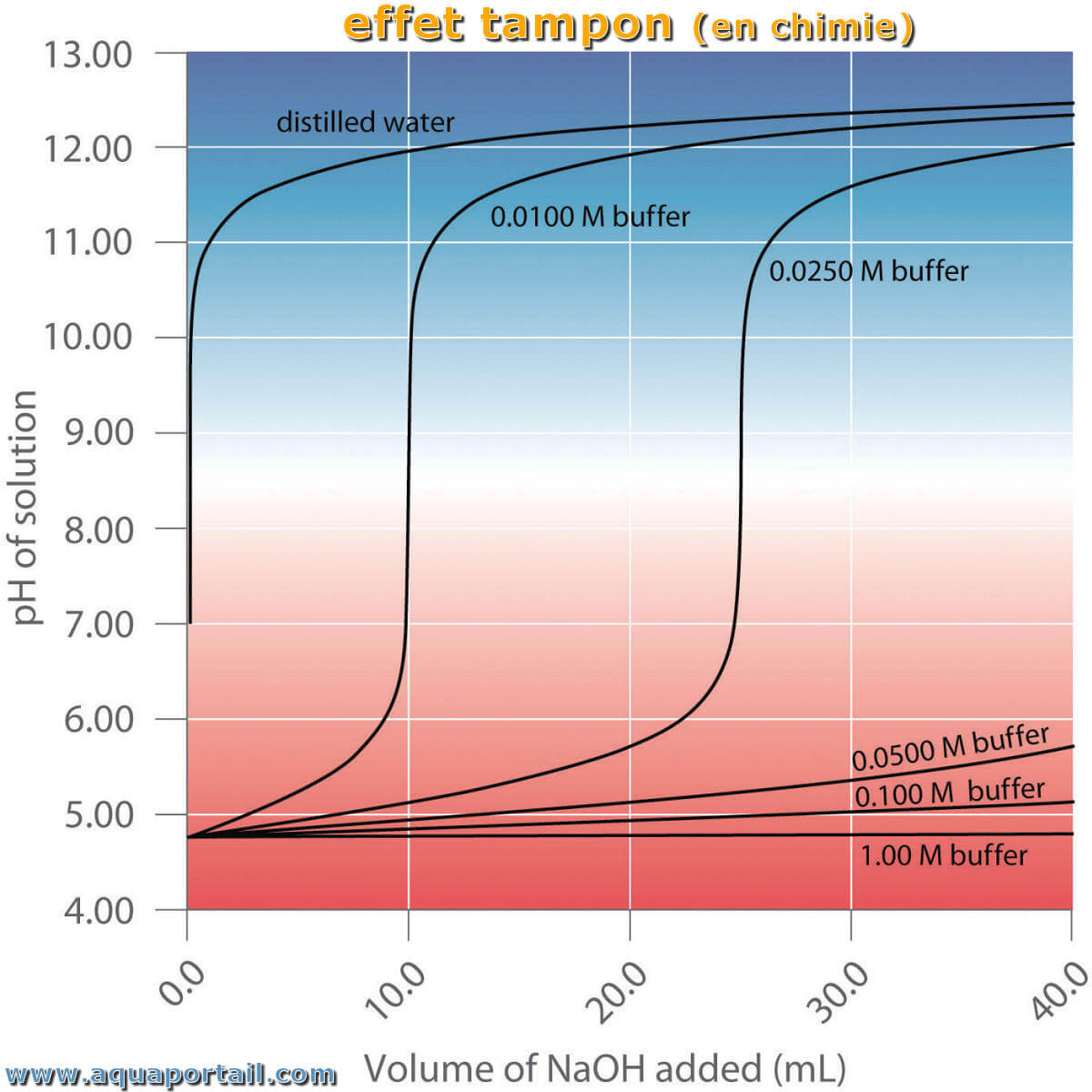
En chimie, l'effet tampon est un moyen par lequel un liquide maintient son pH, le tampon est alors considéré comme un stabilisant.
