Neurotensine
Définition
La neurotensine est un tridécapeptide présent dans le système nerveux central (SNC) et le tractus gastro-intestinal. Elle se comporte comme un neurotransmetteur dans le cerveau et comme une hormone dans l'intestin. La neurotensine est un peptide de 13 acides aminés initialement détecté dans l'hypothalamus bovin.
La structure de la neurotensine :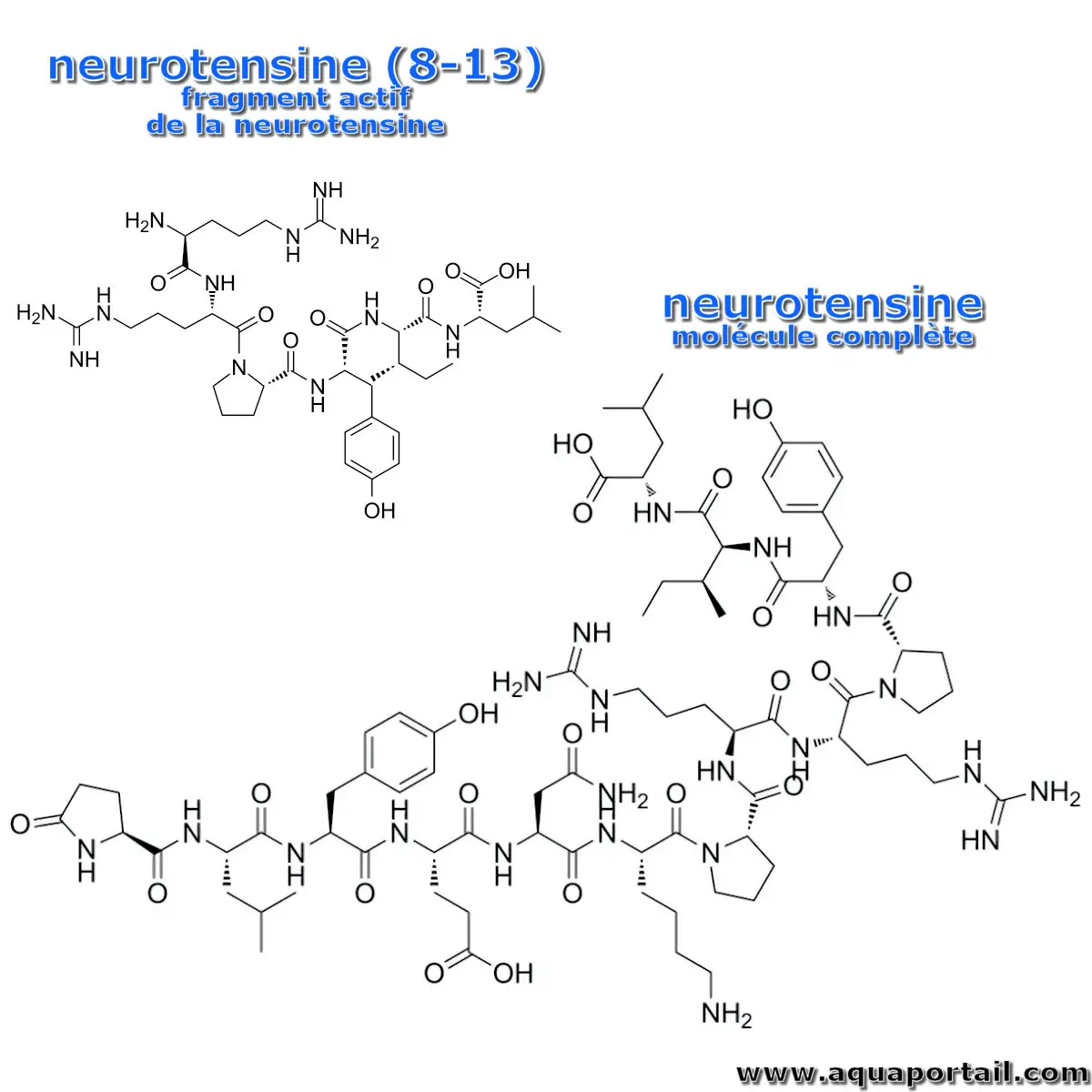
La neurotensine (8–13) est un fragment actif de la neurotensine. La neurotensine (8–13) entraîne une diminution de la densité des récepteurs NT1 (NTR1) à la surface cellulaire. La neurotensine (NT) est un peptide de 13 acides aminés (N-tert-Glu-Leu- Tyr-Glu-Lys-Asn- Pro-Arg- Arg-Pro-Tyr- Ile-Leu-C-ter) isolé par Carraway et Leeman en 1973. Les 13 acides aminés sont dérivés d'un précurseur de 170 acides aminés.
Explications
La neurotensine est un tridécapeptide initialement isolé et caractérisé à partir de l'hypothalamus bovin et plus tard, sous une forme identique, à partir de l'intestin bovin et humain. Chez le rat, environ 85 % de la neurotensine immunoréactive se trouve dans l'intestin et environ 10 % dans le cerveau.
La neurotensine active l'activité dopaminergique et noradrénergique hypothalamique à l'état basal mais pas à jeun. L'administration centrale augmente l'hormone adrénocorticotrope plasmatique (ACTH) et la corticostérone en améliorant la libération du facteur de libération corticale (CRF) dans le système porte hypophysaire.
Les peptides liés à la neurotensine comprennent la neuromédine N (un peptide de type neurotensine à 6 acides aminés cocodé dans la proneurotensine), la xénine et la xénopsine. Dans le tractus gastro-intestinal, le traitement favorise la génération de neurotensine dans les cellules N de l'iléon et dans les neurones entériques. La neurotensine est également produite dans les systèmes nerveux central et périphérique, le coeur, les surrénales, le pancréas et les voies respiratoires. La sécrétion de neurotensine est stimulée par les nutriments luminaux, notamment les lipides, mais pas par les acides aminés ou les glucides.
Le GRP stimule également la libération de neurotensine et la somatostatine exerce un effet inhibiteur. Le GRP (peptide libérant la gastrine) est un neuropeptide, une molécule régulatrice codée chez l'humain par le gène GRP.
L'ingestion de graisse est le stimulant le plus puissant de la libération de neurotensine gastro-intestinale; le glucose et les acides aminés provoquent des augmentations insignifiantes.
La neurotensine régule la fonction hypophysaire antérieure à la fois par sa libération depuis la terminaison nerveuse de l'éminence médiane et par les effets autocrines/paracrines de la neurotensine synthétisée dans l'hypophyse antérieure. L'expression de la neurotensine hypothalamo-hypophysaire est régulée par les hormones gonadiques et stéroïdiennes.
Effets
La neurotensine a une variété d'effets biologiques, avec plus de 30 effets différents in vitro et in vivo connus. Les effets périphériques comprennent la vasodilatation, la cyanose, la libération accrue d'histamine, la stimulation du pancréas endocrinien et exocrine, les effets sur l'activité et la motilité des muscles lisses du tractus gastro-intestinal, la stimulation de la sécrétion intestinale et l'inhibition du flux sanguin vers le tissu adipeux. Au niveau central, la neurotensine a des effets hypothermiques et antinociceptifs et module les systèmes dopaminergiques cérébraux, l'hormone lutéinisante (LH) et la libération de prolactine.
La sécrétion de neurotensine est stimulée par un repas contenant des graisses et a été postulée comme médiateur de nombreux effets de l'ingestion de graisses. Ceux-ci incluent l'inhibition de la sécrétion et de la motilité de l'acide gastrique, la stimulation des sécrétions pancréatiques et intestinales, la diminution du flux sanguin du tissu adipeux et l'augmentation du flux sanguin de l'intestin grêle. La neurotensine potentialise les actions de la sécrétine, de la cholécystokinine et du canal vague sur la sécrétion pancréatique et agit de concert avec d'autres entérogastrones, telles que la sécrétine, pour inhiber la sécrétion d'acide gastrique.
Les effets neuroendocriniens de la neurotensine sont extrêmement complexes et dépendent de la voie d'administration, du statut des stéroïdes sexuels et de l'espèce. En outre, il reste des questions en suspens concernant la séparation des effets physiologiques des effets pharmacologiques et du mode d'action (neurocrine, autocrine, paracrine ou endocrine).
La neurotensine induit l'expression de MIP-2, MCP-1, IL-1 et TNF dans les cellules microgliales murines et stimule la sécrétion d'IL-8 dans une lignée cellulaire épithéliale du côlon non transformée transfectée de manière stable avec le NTR. Le NTR de haute affinité, membre de la famille des récepteurs couplés aux protéines G (GPCR), est présent dans la majorité des cancers pancréatiques et colorectaux humains, ce qui suggère que la neurotensine (NT) pourrait agir de manière endocrinienne pour affecter la croissance tumorale. La neurotensine, un tridécapeptide intestinal, agit comme un puissant mitogène cellulaire pour divers cancers colorectaux et pancréatiques qui possèdent des récepteurs de neurotensine (NTR) de haute affinité.
Neuromédine
La neuromédine N est un peptide de type neurotensine à 6 acides aminés cocodé dans la proneurotensine, un hexapeptide qui partage une séquence C-terminale avec la neurotensine.
La neurotensine est synthétisée dans un précurseur de 170 acides aminés qui code également pour le peptide apparenté neuromédine N. Ces deux peptides sont situés près de l'extrémité C-terminale et sont séparés par des paires de résidus basiques. Le gène neurotensine/neuromédine N de rat a 10,2 kb et est divisé en quatre exons, l'exon 4 contenant la région codante pour la neurotensine et la neuromédine N. Deux espèces d'ARNm ont été identifiées (1,0 et 1,5 kb), la différence étant la longueurs de la queue non traduite 3′. Un schéma similaire est observé chez l'humain. La forme de 1,0 kb prédomine dans l'intestin et l'hypophyse, avec des quantités équivalentes de formes de 1,0 et 1,5 kb dans le cerveau et dans les tumeurs.
Neurolysine
La neurolysine (EC 3.4.24.16) est une métallopeptidase à base de zinc qui clive préférentiellement la protéine neurotensine. Le clivage est généralement effectué à la suite d'un résidu de l'acide aminé proline. La neurolysine, une protéine monomère d'environ 78 kDa, est associée à une neurolyse.
La neurolysine :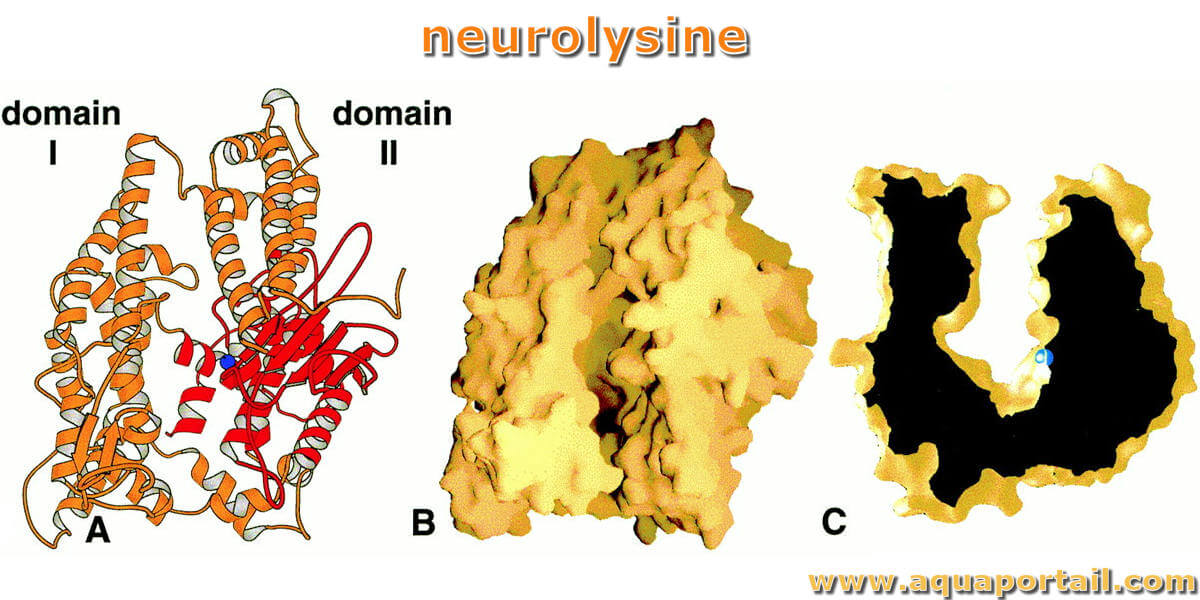
La structure de la neurolysine révèle un canal profond qui limite l'accès au substrat.
La structure de la neurolysine, une peptidase, forme un canal étroit et profond. Cette structure est responsable de la haute spécificité des neuropeptidases. En outre, des études indiquent que la longueur de l'extrémité N-terminale de la carcasse sur le site d'hydrolyse est limitée à environ dix résidus en raison de la taille limitée de la concavité active du site. Les caractéristiques structurelles peuvent clarifier la capacité de clivage d'une variété de séquences.
La neurolysine (en tant que "métalloendopeptidase microsomale") pourrait être située dans le réticulum endoplasmique et contribuer au traitement post-traductionnel des protéines sécrétées.
La cristallographie aux rayons X montre que la neurolysine de métallopeptidase de zinc a de grands éléments structurels érigés sur la région du site actif qui permettent l'accès au substrat uniquement par un canal étroit et profond. Cette architecture explique la spécialisation de cette neuropeptidase en petits substrats peptidiques bioactifs sans structures secondaires et tertiaires volumineuses. De plus, des études de modélisation indiquent que la longueur d'un substrat N-terminal jusqu'au site d'hydrolyse est limitée à environ 10 résidus par la taille limitée de la cavité du site actif. Certains éléments structuraux de la neurolysine, notamment un feuillet β à cinq brins et les deux hélices de sites actifs, sont conservés avec d'autres métallopeptidases. Les régions de boucle de connexion de ces éléments, cependant, sont très étendues dans la neurolysine, et elles, avec d'autres éléments de bobine ouverts, tapissent la cavité du site actif. Ces éléments potentiellement flexibles peuvent expliquer la capacité de l'enzyme à cliver une variété de séquences.
L'endopeptidase 24.15 (EP24.15; oligopeptidase) et l'endopeptidase 24.16 (EP24.16; neurolysine) sont étroitement apparentées (80 % de similarité et 63 % d'identité dans les séquences d'acides aminés) des métalloenzymes à zinc qui contiennent le motif de liaison au zinc HE20H. Ils sont actifs à pH neutre et clivent un certain nombre de peptides biologiquement actifs in vitro. Les deux enzymes sont abondantes dans le cerveau et ont été purifiées à partir d'homogénats de cerveau de rat.
Synonymes, antonymes
Voir tous les synonymes pour "neurotensine".0 synonyme (sens proche) pour "neurotensine".
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à NEUROTENSINE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot NEUROTENSINE est dans la page 1 des mots en N du lexique du dictionnaire.
Mots en N à proximité
neuropile neuropode neurorécepteur neurosécrétion neurosécrétoire neurotensineneurotoxine neurotoxique neurotransmetteur neurotrope neurotrophine
En rapport avec "neurotensine"

Une neurotoxine est une toxine qui agit spécifiquement sur le tissu du système nerveux, même à faible dose.

Un neurotransmetteur est une substance chimique endogène qui permet aux neurones de communiquer entre eux dans tout le corps via la transmission synaptique.
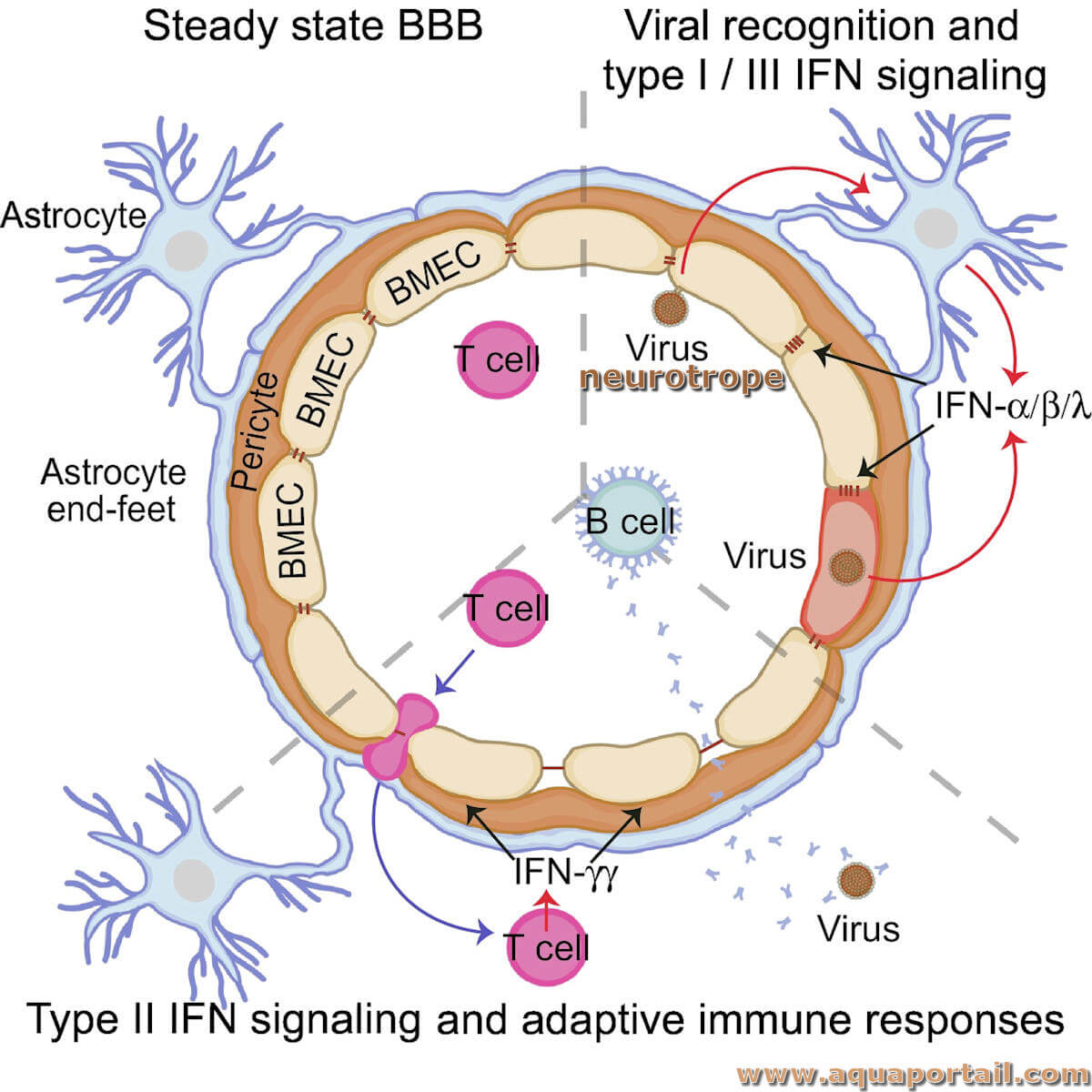
Une souche neurotrope se fixe sur le tissu nerveux, en relation avec un neurone. En médecine, une substance (ou micro-organisme) neurotrope atteint ou se fixe...
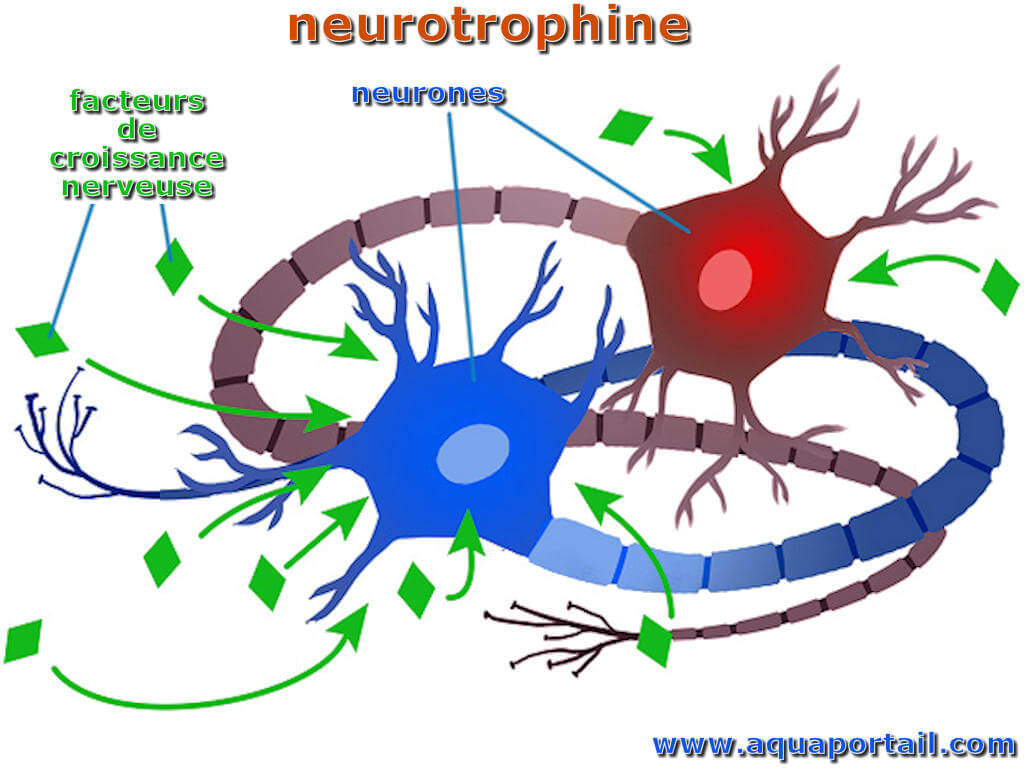
Au cours du développement nerveux, les neurotrophines aident les cellules nerveuses à décider si elles vont vivre ou mourir.
