La palmitoylation (palmitylation)
La palmitoylation (palmitylation) est une forme majeure d'acylation grasse, dans laquelle le palmitate de 16 carbones (ou d'autres acides gras, par exemple, l'acide stéarique à 18 carbones) sont attachés aux résidus de cystéine. En raison de la nature labile de la liaison thioester, la S-palmitoylation est réversible, et les protéines S-palmitoylées peuvent subir des cycles d'acylation et de désacylation en réponse à des signaux en amont.
Processus de palmitylation :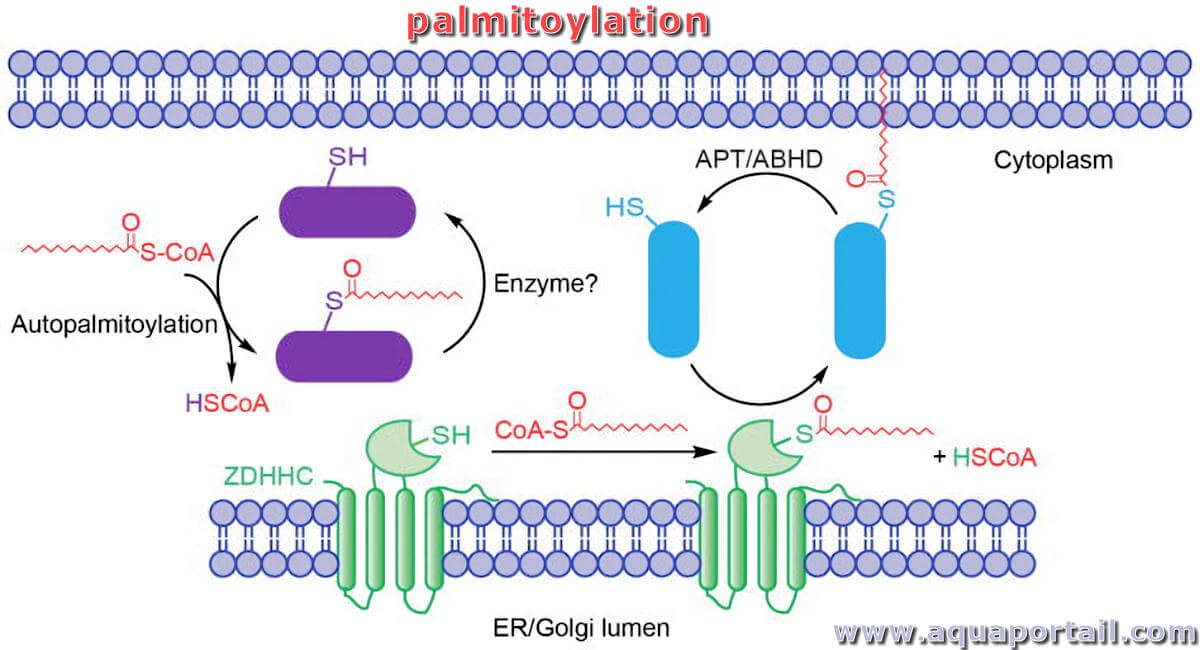
Processus de régulation dynamique d'une protéine par S-palmitoylation. Les palmitoyl acyltransférases (enzymes de la famille ZDHHC, LPCAT) ou l'autopalmitoylation sont impliquées dans l'ajout de palmitate au résidu de protéines Cys (cystéine). Les thioestérases ou lipases (APT et ABHD) pourraient éliminer la chaîne lipidique des protéines.
Généralités
Bien que la palmitoylation soit souvent le type le plus courant d'acylation S, d'autres groupes acyles saturés et insaturés pourraient être utilisés. Étant donné que les groupes acyles d'origine sont éliminés au cours du processus d'échange, il serait impossible de distinguer les différents groupes acyles initialement attachés aux protéines en utilisant ABE ou APE seul.
Par conséquent, pour analyser la préférence des chaînes lipidiques, des méthodes à base de lipides doivent être utilisées, telles que les rapporteurs chimiques bioorthogonaux, qui sont généralement des alcynes terminaux ou des dérivés azido de lipides (acides gras, stérols ou isoprénoïdes).
Les rapporteurs chimiques exogènes peuvent être pris, convertis en acyl-CoAs ou autres intermédiaires et utilisés comme donneurs de lipides dans les cellules. Par conséquent, les cellules vivantes sont nécessaires au profilage métabolique de la lipidation des protéines. Les rapporteurs chimiques peuvent être détectés en utilisant la cycloaddition d'azide-alcyne catalysée par le cuivre (CuAAC) (réaction de clic) avec de la biotine ou des étiquettes fluorescentes.
Les sondes d'acides gras ω-alkynyles sont généralement plus efficaces avec une sensibilité plus élevée pour la détection que les acides gras azido. Les acides gras ω-alcynyles avec différentes longueurs de chaîne peuvent être utilisés pour évaluer différents types de lipidation, tels que la myristoylation, la palmitoylation, la stéaroylation et la prénylation. En outre, les rapporteurs chimiques permettent également la détection de l'acylation graisseuse monoinsaturée, de la prénylation et de l'acylation N ou O, qui n'ont pas pu être détectées par des méthodes d'échange d'acyles.
En outre, la méthode d'imagerie par ligature de proximité chimique du clic rapportée peut être utilisée pour détecter la localisation subcellulaire des protéines acylées grasses. Comme l'ajout du groupe alcynyle a prolongé la chaîne graisseuse pour 2 carbones supplémentaires, il faut être prudent lors de la sélection des rapporteurs appropriés. La chaîne carbonée totale, y compris les 2 carbones du groupe alcynyle, permet de représenter la longueur de la chaîne acyle.
De plus, comme le labeling métabolique nécessite des concentrations élevées de rapporteurs (50 à 100μM), il serait difficile d'évaluer les niveaux de lipidation sous les concentrations physiologiques des donneurs d'acyle endogènes. La combinaison du profilage métabolique des rapporteurs chimiques, ainsi que des méthodes d'échange d'acyle permet une analyse plus claire de la lipidation des protéines.
Régulation réversible dans la signalisation cellulaire
Palmitoyl-CoA est l'un des acyl-CoA gras les plus abondants dans les cellules, et un intermédiaire commun pour la biosynthèse d'autres molécules lipidiques complexes. Les analyses protéomiques ont identifié plus de 1 000 protéines S-palmitoylées. Le protéome palmitoylé pourrait être encore plus grand, et l'outil de bioinformatique SwissPalm a prédit plus de 5 000 protéines S-palmitoylées possibles.
Par conséquent, la compréhension des fonctions de la S-palmitoylation est essentielle pour la signalisation cellulaire et les thérapies. Il a été largement étudié que la S-palmitoylation joue un rôle important dans la régulation de la transmission synaptique. Du côté présynaptique, de nombreuses protéines S-palmitoylées, dont GAD65, SNAP25 et CSP, sont impliquées dans la synthèse et la libération de neurotransmetteurs. Les protéines G hétérotrimères, constituées de sous-unités α, β et γ, sont des transducteurs de signaux des RCPG. Une étude récente a montré que la S-palmitoylation de Gαi1 régule son interaction avec les radeaux lipidiques et affecte sa localisation du microdomaine membranaire.
La s-palmitoylation est l'une des modifications lipidiques les mieux étudiées, qui ont un impact sur divers processus biologiques. La S-palmitoylation peut être régulée dynamiquement par des palmitoyl-acyltransférases contenant du DHHC (Asp-His-His-Cys) (famille ZDHHC de PATs) et des thioestérases de protéines acyliques (APT1 et APT2). De plus, certaines protéines peuvent se lier directement au palmitoyl-CoA et subir une autopalmitoylation indépendante du PAT. Ci-dessous, nous nous concentrerons sur les progrès récents de l'étude des nouvelles fonctions et réglementations de la S-palmitoylation.
Régulation des fonctions des récepteurs immunitaires
La S-palmitoylation des récepteurs immunitaires joue un rôle important dans la réponse immunitaire innée, liant le métabolisme des lipides à la défense et à l'immunité de l'hôte. La voie cyclique GMP-AMP synthase (cGAS)-stimulateur des gènes de l'interféron (STING) est essentielle à la signalisation intracellulaire de l'immunité innée. STING est S-palmitoylé, et cette modification favorise son regroupement au niveau de la membrane trans-Golgi, où il recrute et active TBK1 pour phosphoryler IRF3 et induire la réponse à l'interféron de type I.
L'inhibition pharmacologique de la palmitoylation STING S, ou mutation de ses sites de palmitoylation S, bloque la réponse à l'interféron de type I. De plus, les protéines ZDHHC localisées par Golgi (ZDHHC3, 7 et 15) sont des enzymes candidates potentielles responsables de la palmitoylation STING S. Fait intéressant, ZDHHC1 localisé par ER est également nécessaire pour l'activation et le recrutement des effecteurs en aval TBK1 et IRF3 lors d'une infection par le virus de l'ADN, ce qui implique la nouvelle fonction des protéines ZDHHC dans la signalisation immunitaire. D'autres études sont nécessaires pour comprendre si les ZDHHC3, 7 et 15, ou ZDHHC1 jouent un rôle régulateur dans les réponses immunitaires dépendantes de STING.
Des études protéomiques chimiques ont montré que la palmitoylation S de plusieurs récepteurs de type Toll (TLR) est importante pour leurs fonctions. Par exemple, la palmitoylation S de TLR2 est nécessaire pour sa localisation correcte de la surface cellulaire et l'expression génique nf-κB-dépendante et la production de cytokines en réponse à PAM3CSK4. Un mutant de TLR2 déficient en palmitoylation a partiellement perdu sa capacité à activer l'expression génique dépendante de NF-κB. De plus, il a été démontré que la palmitoylation S de TLR2 est médiée par plusieurs ZDHHC-PATs, y compris ZDHHC2, 3, 6, 7 et 15.
Régulation médiée par la S-palmitoylation
L'établissement adéquat des jonctions cellulaires est essentiel à l'identité cellulaire et souvent perturbé dans les cancers. Plusieurs protéines jonctionnelles sont S-palmitoylées. Par exemple, les membres de la famille des claudines contiennent des cystéines proximales membranaires, qui sont palmitoylées en S. Le mutant déficient en palmitoylation localisé moins à des jonctions serrées et a été localisé dans les lysosomes à la place, suggérant que la palmitoylation régule son trafic.
La molécule d'adhésion jonctionnelle C (JAM-C) est impliquée dans la migration cellulaire, l'angiogenèse, l'adhésion cellulaire et la polarité. JAM-C est palmitoylé par ZDHHC7, favorisant ainsi la localisation jonctionnelle et inhibant la migration des cellules cancéreuses. La protéine de polarité cellulaire Scribble (SCRIB) se localise dans les jonctions cellule-cellule et joue un rôle régulateur dans la détermination de la polarité des cellules épithéliales. Nous avons récemment constaté que la S-palmitoylation de SCRIB à deux résidus de cystéine membrane-proximal conservés est nécessaire pour sa localisation membranaire appropriée. ZDHHC7 est l'acyltransférase primaire et APT2 est une enzyme dépalmitoylante majeure de SCRIB.
Par conséquent, la palmitoylation pourrait être un mécanisme de régulation conservé et commun pour réguler de nombreuses protéines jonctionnelles et la polarité cellulaire.
La s-palmitoylation joue un rôle régulateur important dans la signalisation des protéines GPCR. L'activation induite par les agonistes de la protéine β2AR canonique gpCR humaine a conduit à une palmitoylation S améliorée. Le cycle de palmitoylation et de dépolamitoylation β2AR est médié par les ZDHHC9, 14 ou 18 et APT1, respectivement.
La rhodopsine forme des dimères et des oligomères supérieurs lors de l'activation par la lumière, et peut se lier aux radeaux lipidiques (raftophilie). La palmitoylation est nécessaire pour la raftophilicité dépendante de la dimérisation de la rhodopsine, jouant un rôle important dans l'organisation supramoléculaire et la réponse à la faible lumière. Le récepteur de la mélanocortine-1 (MC1R) est un RCPG spécifique des mélanocytes et joue un rôle important dans la pigmentation. Mc1R est palmitoylé à Cys315, essentiel pour l'activation de MC1R et la protection contre la mélanomésie.
Les tyrosine kinases, y compris les récepteurs (RTK) et les tyrosine kinases non réceptrices (nRTK), fonctionnent dans un large éventail de voies clés de transduction du signal. Les RTK et les nRTK peuvent être modifiés par S-palmitoylation. La famille Src de nRTK, y compris Src, Yes, Fyn, Fgr, Lyn, Hck, Lck, Blk et Frk, est palmitoylée. La S-palmitoylation de Lyn est nécessaire pour son rôle protecteur contre la mauvaise ségrégation chromosomique pendant le cycle cellulaire.
Le récepteur du facteur de croissance épidermique (EGFR) est un RTK important associé à la tumorigenèse. La S-palmitoylation de l'EGFR à Cys797 est nécessaire pour sa dimérisation et son activation, qui dépend de l'acide gras synthase (FASN). Fait intéressant, l'EGFR est également palmitoylé en S au C-terminal Cys1025 et Cys1122, médié par ZDHHC20. Les deux études ont montré que la S-palmitoylation joue un rôle négatif dans l'activation de l'EGFR et que l'inhibition de la s-palmitoylation de l'EGFR peut être en synergie avec la mort cellulaire induite par les inhibiteurs de l'EGFR.
Régulation des facteurs de transcription
Le récepteur des oestrogènes α (ERα) se localise à la fois dans le noyau et dans la membrane plasmique. La palmitoylation S à Cys451 est essentielle pour la translocation ERα, la localisation de la membrane plasmique et l'interaction avec la protéine membranaire cavéoline-1. Un modèle murin avec ERα déficient en palmitoylation (C451A) a été généré pour obtenir une perte de fonction spécifique à la membrane. Le récepteur ERα lié à la membrane est essentiel à la fonction ovarienne, y compris la fertilité et la physiologie vasculaire.
En revanche, l'ERα nucléaire est nécessaire pour servir de médiateur à la réponse utérine aux ligands d'oestrogènes. Par conséquent, la S-palmitoylation de l'ERα a des fonctions tissulaires distinctes in vivo. De même, le récepteur des androgènes (RA) est palmitoylé S, ce qui favorise le ciblage de la membrane AR. Plusieurs variantes d'épissage AR sont fortement régulées à la hausse dans les cellules du cancer de la prostate résistantes à la castration (CRPC).
La variante AR8 a été principalement localisée sur la membrane plasmique, peut-être par palmitoylation. Le mutant d'AR8 déficient en palmitoylation a perdu la localisation de la membrane et sa capacité à recruter Src et EGFR. Par conséquent, la localisation membranaire dépendante de la palmitoylation des variantes de raA peut jouer un rôle dans le développement du CRPC.
Les facteurs de transcription du domaine TEA (TEAD1–4) sont S-palmitoylés aux résidus de cystéine conservés par un mécanisme d'autopalmitoylation non-enzymatique. Lorsqu'il est incubé avec une concentration physiologique de palmitoyl-CoA, TEAD2 subit une autopalmitoylation efficace avec apparent Km d'environ 1 μM. Nous et d'autres avons constaté que la chaîne palmitoyl est profondément enfouie dans la poche hydrophobe conservée. La s-palmitoylation est nécessaire pour la liaison teaD au co-activateur de transcription YAP/TAZ et sert de médiateur à la sortie transcriptionnelle de la voie Hippo.
Fait intéressant, la palmitoylation S ne modifie pas la localisation nucléaire de TEAD1 et pourrait fonctionner comme un motif structurel pour rigidifier la confirmation des TEAD. On ne sait toujours pas si le niveau de palmitoylation TEAD est régulé par des signaux en amont, des concentrations intracellulaires de palmitoyl-CoA et le processus de dépalmitoylation.
Régulation dynamique de la S-palmitoylation
La S-palmitoylation des protéines peut être médiée par la famille ZDHHC d'enzymes palmitoylantes. Ces enzymes catalysent l'ajout de palmitate aux protéines du substrat par un processus en deux étapes : l'autoacylation et la formation intermédiaire acyl-enzyme, suivie du transfert de la chaîne acyle à un résidu spécifique de cystéine dans la protéine du substrat.
Chez les mammifères, les protéines ZDHHC sont codées par plus de 20 gènes distincts. Les ZDHHC-PATs sont généralement localisés dans l'ER, Golgi ou la membrane plasmique. Bien que certains substrats de différentes protéines ZDHHC aient été identifiés, la spécificité du substrat de ces enzymes n'est pas bien comprise. Une possibilité est que les régions en dehors du domaine DHHC déterminent la spécificité du substrat. Une étude structurale récente suggère que deux résidus conservés dans le domaine de répétition de l'ankyrine de ZDHHC17 jouent un rôle essentiel dans la liaison à son substrat SNAP25b.
En outre, la localisation intracellulaire des ZDHHC pourrait également spécifier les interactions avec les substrats. Des altérations génétiques des gènes ZDHHC sont observées dans diverses maladies, y compris le cancer et les maladies neurologiques. Plusieurs membres de la famille ont été impliqués dans le processus physiologique et pathologique humain. ZDHHC2 affiche des activités vers un large éventail de substrats, et a été rapporté comme un suppresseur de tumeur potentiel dans plusieurs cancers humains.
En revanche, ZDHHC5 catalyse la palmitoylation de l'EZH2 et pourrait fonctionner comme une oncoprotéine, contribuant à la progression du gliome muté par p53 et du cancer du poumon non à petites cellules. ZDHHC9 médie la palmitoylation de N-Ras et H-Ras, et les altérations de ZDHHC9 sont associées à un retard mental lié à l'X et au cancer colorectal. La perte de ZDHHC13 ou ZDHHC21 entraîne des défauts capillaires, mais ces deux PATs montrent des préférences de substrat différentes.
De plus, ZDHHC13 joue un rôle important dans la fonction mitochondriale et le métabolisme dans le foie, et est lié à la cancérogenèse cutanée et à la maladie de Huntington (MH). Le déficit en ZDHHC21 entraîne une inflammation endothéliale et un syndrome de réponse inflammatoire systémique.
Ces données biochimiques et génétiques suggèrent que les PAT sont impliqués dans diverses fonctions cellulaires, et que la spécificité du substrat et la redondance fonctionnelle des différents ZDHHC-PATs nécessitent des études minutieuses et détaillées. Des inhibiteurs spécifiques peuvent devoir être développés pour différents PATs, ce qui nécessitera des efforts importants en chimie structurelle, biochimique et médicinale.
En rapport avec "palmitoylation"
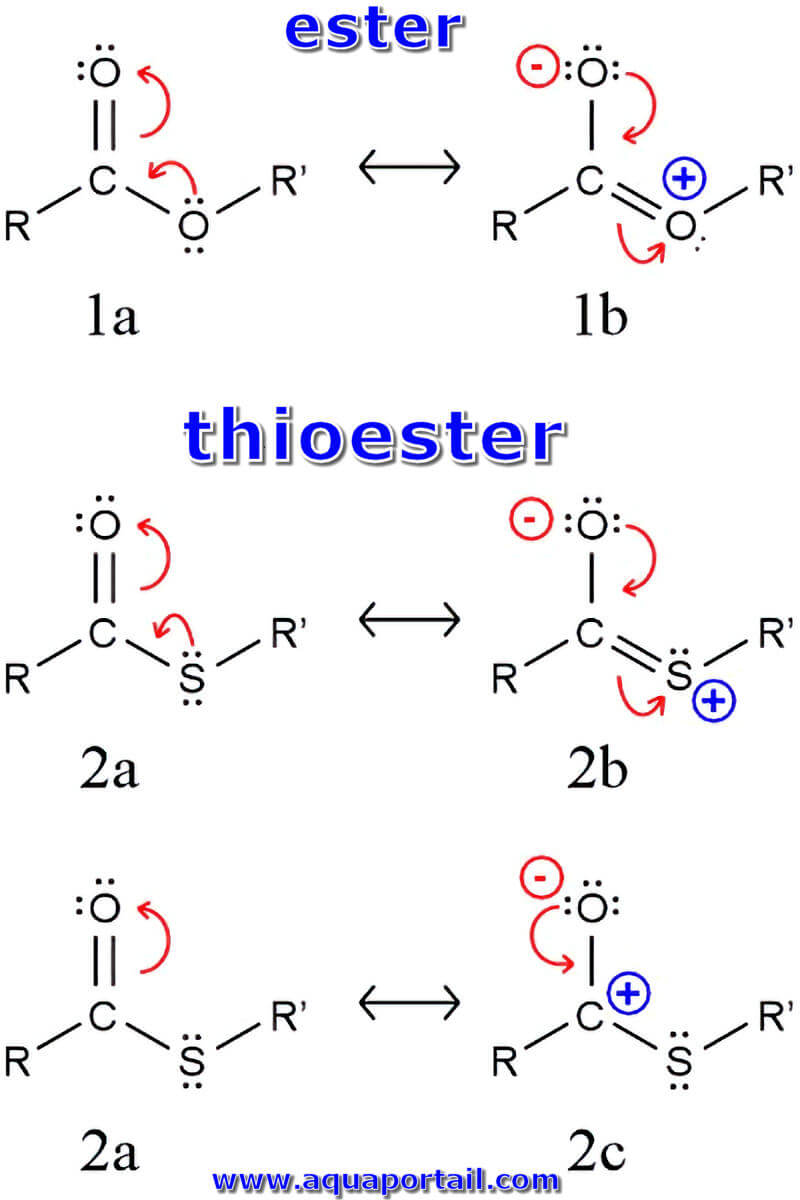
Un thioester est un produit de condensation qui peut s'être formé par la voie des peptides au cours des origines de la vie.

Une acétylation est un transfert d'un groupe acétyle CH₃-CHO sur une molécule réceptrice.

L'acylation est une réaction dans laquelle un groupe acyle est ajouté à une molécule. L'acylation est un moyen pratique de séparer les amines tertiaires d'un...

L'alkylation est le transfert d'un groupe alkyle d'une particule en mouvement à une autre molécule au repos.
