Ankyrine
Définition
Une ankyrine désigne une protéine de liaison intracellulaire de grande taille, liant la spectrine au domaine cytoplasmique de la bande 3, donc à la membrane plasmique de l'hématie.
Les ankyrines sont des protéines de répétition qui appartiennent aux protéines de liaison, comme les anticorps. Les ankyrines sont des protéines cytosquelettiques qui interagissent avec les protéines membranaires intégrales via des liaisons dynamiques non covalentes et participent à leur distribution dans la membrane cellulaire.
Un fragment d'ankyrine humaine :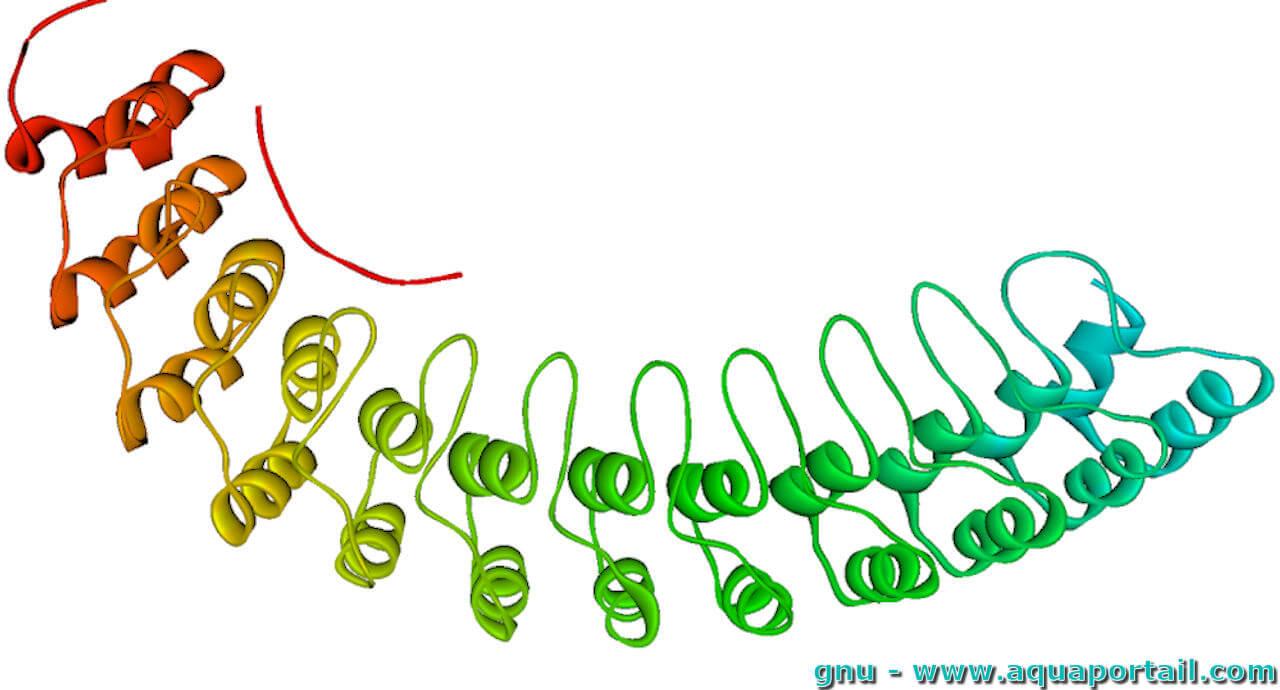
Ici, une partie de la structure de l'ankyrine lie la membrane avec le schéma en ruban d'un fragment du domaine de liaison membranaire de l'ankyrine érythrocytaire humaine (ankyrine 1, ankyrine R).
Explications
Dans les érythrocytes, la spectrine se lie à la membrane cellulaire via l'ankyrine.
Voir aneurine et antipyrine.
La sphérocytose héréditaire est basée sur une délétion du gène de l'ankyrine dans environ la moitié des cas. plasmodium falciparum se lie à l'ankyrine. ANK3 (ankyrine G) peut être impliqué dans le développement de troubles bipolaires.
Structure
Les ankyrines sont une famille de protéines qui intervient dans la fixation de protéines membranaires intégrales au cytosquelette membranaire à base de spectrine et actine. Les ankyrines ont des sites de liaison pour la sous-unité bêta de la spectrine et au moins 12 familles de protéines membranaires intégrales. Cette liaison est nécessaire pour maintenir l'intégrité des membranes plasmiques et pour ancrer des canaux ioniques spécifiques, des échangeurs d'ions et des transporteurs d'ions dans la membrane plasmique. Le nom est dérivé du mot grec pour "fusionné".
Les ankyrines contiennent quatre domaines fonctionnels : un domaine N-terminal contenant 24 répétitions d'ankyrine en tandem, un domaine central se liant à la spectrine, un domaine mort se liant à des protéines impliquées dans l'apoptose et un domaine de régulation C-terminal très variable entre protéines d'ankyrine.
Reconnaissance des protéines membranaires
Les répétitions d'ankyrine (24 tandems) sont responsables de la reconnaissance d'un large éventail de protéines membranaires. Ces 24 répétitions contiennent 3 sites de liaison structurellement distincts allant de la répétition 1–14. Ces sites de liaison sont quasi indépendants les uns des autres et peuvent être utilisés en combinaison. Les interactions que les sites utilisent pour se lier aux protéines membranaires sont non spécifiques et consistent en : liaisons hydrogène, interactions hydrophobes et interactions électrostatiques.
Ces interactions non spécifiques confèrent à l'ankyrine la propriété de reconnaître une large gamme de protéines car la séquence ne doit pas être conservée, mais uniquement les propriétés des acides aminés. La quasi-indépendance signifie que si un site de liaison n'est pas utilisé, cela n'aura pas d'effet important sur la liaison globale. Ces deux propriétés combinées donnent lieu à un vaste répertoire de protéines que l'ankyrine peut reconnaître.
La répétition ankyrine
La répétition ankyrine est une configuration de 33 résidus dans des protéines consistant en deux hélices alpha séparées par des boucles, découvertes pour la première fois dans des protéines de signalisation dans la levure Cdc10 et Drosophila (voie de signalisation Notch). Les domaines composés de répétitions d'ankyrine interviennent dans les interactions protéine-protéine et font partie des motifs structurels les plus courants dans les protéines connues. Ils apparaissent dans les protéines bactériennes, archées et eucaryotes, mais sont beaucoup plus fréquents chez les eucaryotes. Les protéines de répétition d'ankyrine, bien qu'elles soient absentes dans la plupart des virus, sont courantes chez les poxvirus. La plupart des protéines contenant le motif ont quatre à six répétitions, bien que son homonyme, l'ankyrine, en contienne 24, et le plus grand nombre connu de répétitions est de 34, prévu dans une protéine exprimée par Giardia lamblia.
Les répétitions d'ankyrine se replient généralement pour former une seule structure linéaire de solénoïde appelée domaines répétés d'ankyrine. Ces domaines sont l'une des plates-formes d'interaction protéine-protéine les plus courantes dans la nature. Ils sont présents dans un grand nombre de protéines fonctionnellement diverses, principalement d'eucaryotes. Les quelques exemples connus de procaryotes et de virus peuvent être le résultat de transferts de gènes horizontaux. La répétition a été trouvée dans des protéines de fonctions diverses telles que les initiateurs de la transcription, les régulateurs du cycle cellulaire, le cytosquelette, les transporteurs d'ions et les transducteurs de signal. Le pli de l'ankyrine semble être défini par sa structure plutôt que par sa fonction, puisqu'il n'y a pas de séquence ou de structure spécifique universellement reconnue par lui.
Considérant les structures atomiques des répétitions individuelles de l'ankyrine, la boucle est souvent une boucle de type bulbe bêta de type 1, alors que les deux hélices alpha ont généralement une boucle de Schellman à leur extrémité N-terminale.
Rôle dans la répétition dans le repliement des protéines
Le motif de séquence à répétition d'ankyrine a été étudié en utilisant un alignement multiple de séquences afin de déterminer les résidus d'acides aminés conservés essentiels au repliement et à la stabilité. Les résidus sur la grande surface latérale des structures répétées de l'ankyrine sont variables, souvent hydrophobes, et interviennent principalement dans la médiation des interactions protéine-protéine. Une conception de protéine artificielle basée sur une séquence consensus dérivée de l'alignement de séquence a été synthétisée et s'est révélée se plier de manière stable, représentant la première protéine conçue avec plusieurs répétitions. Des stratégies de conception plus complètes ont utilisé des séquences combinatoires pour "faire évoluer" les répétitions d'ankyrine reconnaissant des cibles protéiques particulières, technique présentée comme une alternative à la conception d'anticorps pour les applications nécessitant une liaison à haute affinité. Une étude basée sur la structure impliquant une gamme de protéines d'ankyrine de structures connues montre que les protéines d'ankyrine basées sur le consensus sont très stables, car elles maximisent l'écart énergétique entre les structures de pliage et de dépliage, codant ainsi un réseau dense d'interactions favorables entre les structures en conservant de motifs de séquence, comme le motif TPLX.
Les protéines à répétition d'ankyrine posent un problème inhabituel dans l'étude du repliement des protéines, qui s'est largement concentré sur les protéines globulaires qui forment une structure tertiaire bien définie stabilisée par des contacts longue distance résidu-résidu. Les répétitions d'ankyrine, en revanche, contiennent très peu de tels contacts (c'est-à-dire qu'ils ont un ordre de contact faible). La plupart des études ont montré que les répétitions d'ankyrine se plient dans un mécanisme de pliage à deux états, suggérant un degré élevé de coopération de pliage malgré les contacts locaux entre résidus et le besoin évident d'un pliage réussi avec un nombre de répétitions variable. Certaines preuves, basées sur la synthèse de versions tronquées de protéines de répétition naturelles, et sur l'examen des valeurs de phi, suggèrent que l'extrémité C-terminale forme le site de nucléation par repliement.
Signification clinique
Les protéines à répétition d'ankyrine ont été associées à un certain nombre de maladies humaines. Ces protéines comprennent l'inhibiteur du cycle cellulaire p16, associé au cancer, et la protéine Notch (un composant clé des voies de signalisation cellulaire) pouvant provoquer le désordre neurologique CADASIL lorsque le domaine répété est perturbé par des mutations.
Une famille spécialisée de protéines d'ankyrine, connue sous le nom de protéines de répétition d'ankyrine musculaire, participe à la réparation et à la régénération du tissu musculaire à la suite de lésions dues à une blessure ou à un stress.
Une variation naturelle entre la glutamine et la lysine en position 703 dans la 11ème répétition d'ankyrine d'ANKK1, connue sous le nom d'allèle TaqI A1, a été reconnue pour avoir encouragé des comportements de dépendance tels que l'obésité, l'alcoolisme, la dépendance à la nicotine, tout en décourageant la délinquance juvénile et le neuroticisme-anxiété. La variation peut affecter la spécificité des interactions protéiques établies par la protéine kinase ANKK1 à travers cette répétition.
Types
Les ankyrines sont codées par trois gènes (ANK1, ANK2 et ANK3) chez les mammifères. Chaque gène produit à son tour plusieurs protéines grâce à un épissage alternatif :
- ANK1 : le gène ANK1 code pour les protéines Ankyrine R. Ankyrine R a été caractérisée pour la première fois dans les érythrocytes humains, cette ankyrine étant appelée ankyrine ou bande 2.1 des érythrocytes. Ankyrine R permet aux érythrocytes de résister aux forces de cisaillement ressenties dans la circulation. Les individus présentant une ankyrine réduite ou défectueuse ont une forme d'anémie hémolytique appelée sphérocytose héréditaire. Dans les érythrocytes, Ankyrine R relie le squelette membranaire à l'échangeur d'anions Cl-/HCO3-. Ankyrine 1 relie le récepteur membranaire CD44 au récepteur de l'inositol triphosphate et au cytosquelette. Il a été suggéré que ankyrine 1 interagit avec KAHRP (protéine riche en histidine associée à Plasmodium falciparum, démontré par des tirages sélectifs, SPR et ELISA).
- ANK2 : par la suite, les protéines d'ankyrine B (produits du gène ANK2) ont été identifiées dans le cerveau et le muscle. Les protéines Ankyrine B et Ankyrine G sont nécessaires à la distribution polarisée de nombreuses protéines membranaires, notamment la Na+/ K+ ATPase, le canal Na+ dépendant de la tension et l'échangeur Na+/Ca2+.
- ANK3 : les protéines Ankyrine G (produits du gène ANK3) ont été identifiées dans les cellules épithéliales et les neurones. Une analyse génétique à grande échelle réalisée en 2 008 montre la possibilité que ANK3 soit impliqué dans le trouble bipolaire.
Ankyrine et gène ANK2
L'ankyrine 2 est une protéine qui est codée par le gène ANK2 chez l'homme. Ce gène code pour un membre de la famille des protéines de l'ankyrine qui lient les protéines membranaires intégrales au cytosquelette spectrine-actine sous-jacent.
Les ankyrines jouent un rôle clé dans des activités telles que la motilité cellulaire, l'activation, la prolifération, le contact et le maintien de domaines membranaires spécialisés. La plupart des ankyrines sont généralement composées de trois domaines structuraux : un domaine amino-terminal contenant plusieurs répétitions d'ankyrine; une région centrale avec un domaine de liaison à la spectrine hautement conservé; et un domaine régulateur carboxy-terminal qui est le moins conservé et sujet à variation.
La protéine codée par ce gène est nécessaire au ciblage et à la stabilité de l'échangeur Na/Ca dans les cardiomyocytes. Des mutations de ce gène entraînent un syndrome du QT long 4 et un syndrome d'arythmie cardiaque. Plusieurs variantes de transcription codant pour différentes isoformes ont été décrites.
Synonymes, antonymes
Voir tous les synonymes pour "ankyrine".0 synonyme (sens proche) pour "ankyrine".
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à ANKYRINE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot ANKYRINE est dans la page 6 des mots en A du lexique du dictionnaire.
Mots en A à proximité
anisoptère anisostémone anisotrope anisotropie anisotylie ankyrineanmoor anneau anneau ambulacraire anneau de Balbiani anneau de Weismann