Oxalate de calcium
Définition
L'oxalate de calcium (éthanodiate de calcium) est un sel de calcium de l'acide oxalique. Il est un composé chimique du groupe des oxalates qui, chez certaines plantes nuisibles, forme des cristaux en forme d'aiguilles appelés raphides. Sa formule chimique est CaC2O4 ou Ca(COO)2.
Des cristaux d'oxalate de calcium (calculs rénaux) :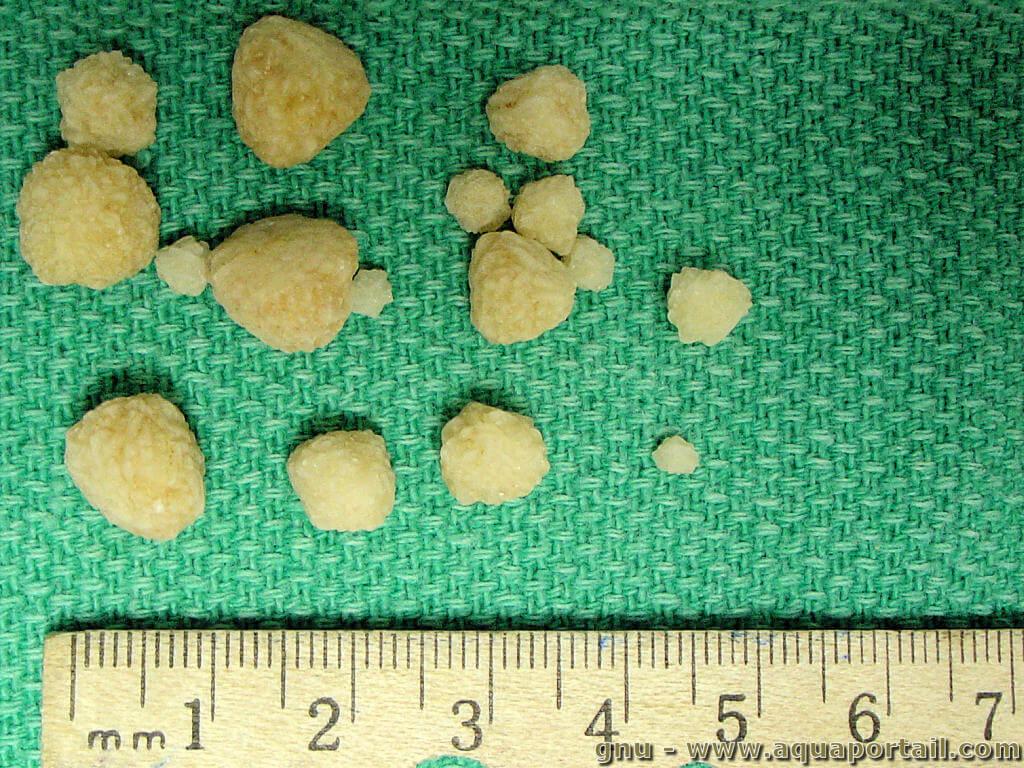
Ces cristaux d'oxalate de calcium trouvés dans la vessie d'un chien forment des calculs rénaux.
Sources d'oxalates
De grandes quantités de raphides (oxalate de calcium de plantes) se trouvent dans la plante toxique Dieffenbachia. Ils sont également trouvés dans les rhubarbes (en particulier dans les feuilles), plusieurs espèces d'Oxalis, Aracées, taros, agaves et autres comme la pariétaire Parietaria officinalis.
Dieffenbachia maculata forme des oxalates de calcium :
Les cellules de la plante Dieffenbachia, ici une plante d'appartement Dieffenbachia maculata, contiennent des cristaux aciculaires d'oxalate de calcium appelés raphides. Si une feuille est mâchée, ces cristaux peuvent provoquer une légère sensation de brûlure et un érythème temporaire. On pense que d'autres enzymes de la plante augmentent le pouvoir des cristaux. De rares cas d'oedème des tissus exposés à la plante ont été rapportés. Mâcher et avaler ne provoque généralement que de légers désagréments, mais le contact avec les gencives dans les yeux ou le sang peut provoquer des problèmes cardiaques.
Contrairement aux raphides toxiques, les cristaux aciculaires d'oxalate de calcium insolubles ne sont tout simplement pas absorbables dans le tube digestif. La combinaison d'oxalates solubles avec du calcium alimentaire dans l'intestin affecte l'absorption de ce métal en formant un oxalate de calcium inabsorbable qui est éliminé dans les fèces; par conséquent, la consommation prolongée de plantes moyennement riches en oxalates solubles a tendance à causer des troubles du squelette, en particulier lorsque le régime alimentaire ne contient pas les quantités adéquates de calcium et de vitamine D.
L'oxalate de calcium est également le composant principal de la pierre de stéatite (littéralement, la "pierre de bière"), un précipité brun qui a tendance à s'accumuler dans les réservoirs, les fûts et les autres récipients utilisés en brasserie. La pierre de bière est composée de sels de calcium et de magnésium et de plusieurs composés organiques générés au cours du processus de brassage. Elle favorise la croissance de micro-organismes indésirables pouvant provoquer des effets indésirables et gâcher le goût d'un lot de bière.
Les cristaux d'oxalate de calcium dans l'urine sont les principaux composants des calculs rénaux et la formation de cristaux d'oxalate de calcium est également l'un des effets toxiques de l'intoxication par l'éthylène glycol.
En plus de ces sources biologiques, l'oxalate de calcium se trouve dans la nature sous forme d'hydrate sous forme de minéraux rares tels que la whewellite et la weddellite. Les sources minérales sont la whewellite (monohydrate connu de certaines couches de charbon, la whewellite est aussi le minéral constitutif des calculs rénaux), la weddellite (dihydrate) et un trihydrate très rare appelé caoxite.
Extraction et présentation
L'oxalate de calcium est un intermédiaire dans la production d'acide oxalique. Dans ce cas, l'oxalate de sodium est converti avec l'hydroxyde de calcium en oxalate de calcium peu soluble, à partir duquel l'acide oxalique est libéré avec de l'acide sulfurique.
Structures cristallines
L'oxalate de calcium anhydre n'existe pas sous forme de monocristal, mais est obtenu par chauffage à partir des hydrates. Sa structure cristalline a donc été déterminée par diffraction des rayons X sur la poudre cristalline et présente une symétrie monoclinique dans le groupe spatial P2/m.
L'oxalate de calcium monohydraté cristallise également dans le système cristallin monoclinique. À température ambiante, le groupe spatial P2 est égal à 1/n et au-dessus de 328 K, le groupe spatial I2/m. L'oxalate de calcium dihydraté cristallise dans le système cristallin tétragonal avec le groupe spatial I4/m. L'oxalate de calcium trihydraté cristallise dans le système cristallin triclinique avec le groupe spatial P1/m.
Propriétés chimiques
L'oxalate de calcium est un sel incolore de l'acide oxalique. Le composé forme un monohydrate stable. Lorsqu'elle est chauffée, l'eau de cristallisation est d'abord libérée à 100 °C. Au-dessus de 300 °C, le composé se décompose pour libérer du monoxyde de carbone et former du carbonate de calcium. Celui-ci se décompose par chauffage supplémentaire au-dessus de 500 °C en oxyde de calcium et dioxyde de carbone.
Les trois étapes de la réaction sont endothermiques. En présence d'oxygène atmosphérique, la deuxième étape réactionnelle se déroule sous la forme d'une réaction d'oxydation exothermique avec formation de dioxyde de carbone. Avec un dihydrate et un trihydrate, deux autres hydrates métastables sont connus.
Utilisations
L'oxalate de calcium sert de preuve des ions calcium. Si une solution contenant de l'oxalate est ajoutée à la solution contenant du calcium à déterminer, l'oxalate de calcium peu soluble précipite. En outre, il sert d'agent de blanchiment et est utilisé comme nettoyant pour métaux. Il est également produit sous forme de couche brillante à la surface des pierres naturelles (voir brillant des pierres naturelles).
L'oxalate de calcium monohydraté est utilisé en thermogravimétrie pour l'étalonnage de la thermobalance.
Effets de l'ingestion
Même une petite dose de raphides est suffisante pour provoquer des sensations de brûlure dans la bouche et la gorge, un gonflement et un choc. Cependant, à fortes doses, les raphides provoquent des troubles digestifs graves, une détresse respiratoire et, si suffisamment consommée, des convulsions, le coma et la mort. Il est possible de récupérer d'une intoxication grave par la raphide.
La tige de Dieffenbachia produit les réactions les plus intenses. Ces cristaux en forme d'aiguilles produisent une douleur et un gonflement au contact des lèvres, de la langue, de la muqueuse buccale, de la conjonctive ou de la peau. L'oedème est principalement dû au traumatisme direct des cristaux en forme d'aiguilles et, dans une moindre mesure, à d'autres toxines de la plante (bradykinines, enzymes, etc.).
Traitement
En cas d'ingestion, un traitement médical immédiat est nécessaire.
En fonction de la plante ingérée, les effets peuvent être légers (oreille d'éléphant Xanthosoma sagittifolium, taro Colocasia esculenta) ou graves (Arisaema), compromettant les voies respiratoires. Une morsure dans la gousse de la graine d'Arisaema produira un gonflement et une sensation de brûlure immédiats. Le gonflement prendra environ 12 heures pour une rémissions.
Les médicaments administrés en cas d'urgence médicale peuvent comprendre le Benadryl (diphénhydramine), l'adrénaline ou la Famotidine, le tout sous forme intraveineuse. Bien qu'il s'agisse probablement d'une réaction localisée, elle sera traitée en cas d'urgence médicale comme une réaction anaphylactique.
Synonymes, antonymes
Voir tous les synonymes pour "oxalate de calcium".2 synonymes (sens proche) de "oxalate de calcium" :
- éthanodiate de calcium
- raphide
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à OXALATE DE CALCIUM sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
L'expression OXALATE DE CALCIUM est dans la page 3 des mots en O du lexique du dictionnaire.
Mots en O à proximité
ovulation ovule ovule de fleur ovulipare oxacide oxalate de calciumoxaloacétate oxamide oxane oxique oxirane
En rapport avec "oxalate de calcium"

L'acide oxalique est l'acide éthanedioïque de formule C₂H₂O₄, communément appelé le sel d'oseille.

Un idioblaste est une cellule spécialisée de tissus végétaux qui contient des composés lipidiques et liposolubles.

Le calcium (Ca) est l'élément chimique (Z = 20) du groupe 2 des alcalino-terreux. Le calcium est le minéral le plus abondant de l'organisme et ses rôles sont...

Le carbonate de calcium (CaCO₃) est un composé naturellement présent sous forme de roche calcaire, caractérisé par sa couleur blanchâtre.
