L'endoderme comme point de contrôle des nutriments
L'endoderme des racines des plantes en détail:Les racines des plantes recherchent des nutriments dans le sol et les transportent vers les parties aériennes. Les nutriments entrant dans la plante sont transportés à travers les couches concentriques de l'épiderme, du cortex et de l'endoderme avant d'atteindre le système vasculaire central. L'endoderme est la couche cellulaire corticale la plus interne qui entoure le système vasculaire.
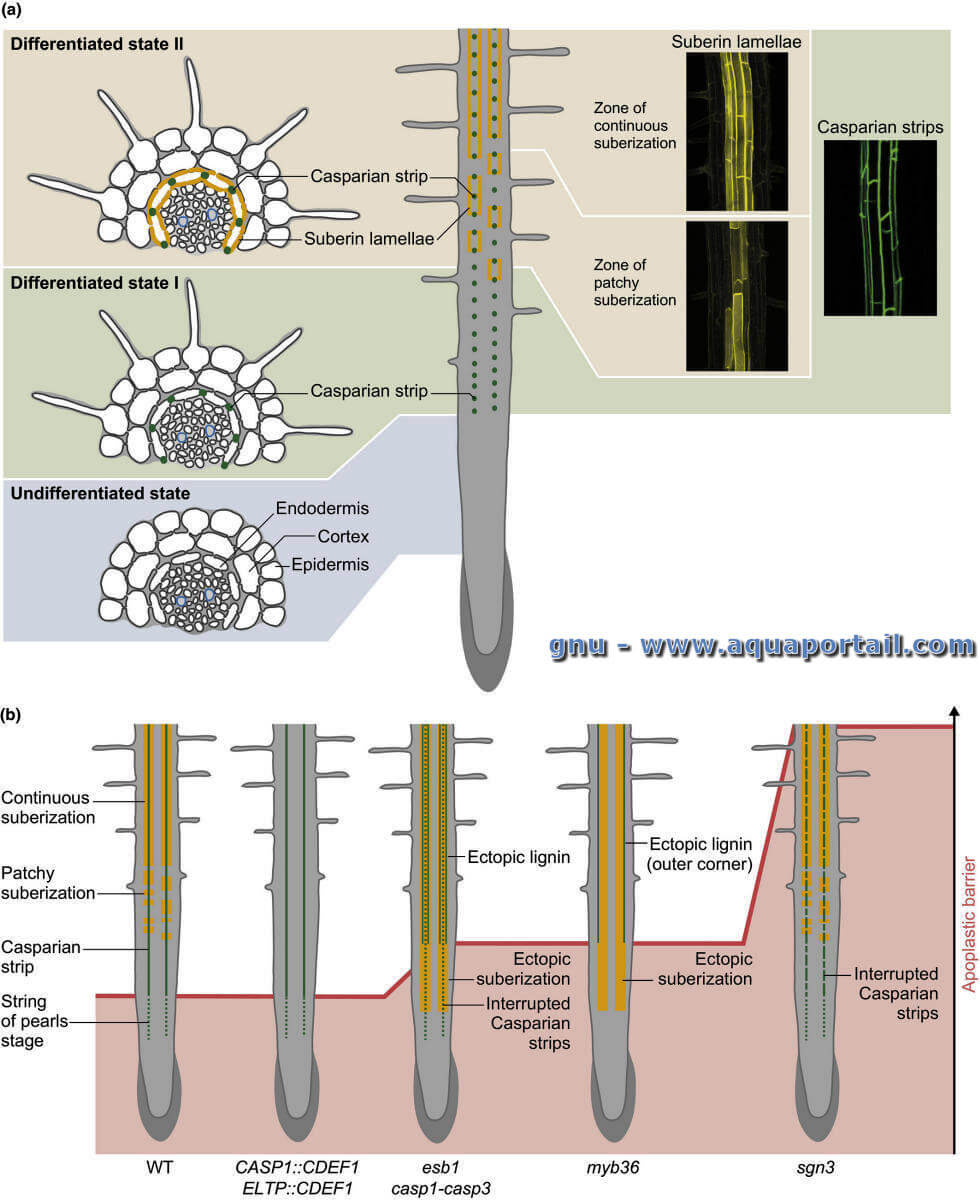
(a) Vues schématiques de la différenciation de l'endoderme, présentées sous forme de vues transversales (panneau de gauche) et longitudinales (panneau du milieu) pour les états indifférenciés et I et II de la différenciation de l'endoderme (pas à l'échelle). Les bandes caspariennes sont illustrées avec la fluorescence CASP1-GFP (vert) et la subérisation avec coloration jaune fluorol (jaune) présentées sous forme de projections 3D (panneaux de droite). (b) Vues schématiques de différents génotypes d'Arabidopsis affectés dans la différenciation de l'endoderme. L'établissement de la barrière apoplastique le long de la racine primaire, mesuré à l'origine comme le nombre de cellules endodermiques où l'iodure de propidium (PI) est bloqué, est représenté en rouge. Les dépôts de lignine et de subérine dans l'endoderme sont représentés par des lignes vertes et orange, respectivement.
L'endoderme forme des barrières, les bandes caspariennes et les lamelles de subérine, qui sont supposées jouer un rôle majeur dans le contrôle de l'acquisition des nutriments. Cependant, le réseau moléculaire contrôlant sa différenciation n'a commencé à être étudié que récemment, ce qui offre une opportunité sans précédent d'aborder le rôle de ces barrières dans la nutrition des plantes. Cet aperçu vise à présenter les avancées récentes concernant la différenciation de l'endoderme, sa fonction de barrière pour les nutriments et sa plasticité développementale, le tout pointant vers un rôle pivot de l'endoderme en tant que point de contrôle des nutriments.
Introduction
Les racines des plantes jouent un rôle central dans la croissance et le développement des plantes en acquérant sélectivement l'eau et les nutriments du sol. Lorsqu'ils pénètrent dans la racine, l'eau et les nutriments sont transportés à travers les couches de cellules radiculaires concentriques du cortex et de l'endoderme de l'épiderme avant d'atteindre le système vasculaire central, avec ses vaisseaux xylèmes les distribuant aux différents organes de la plante. En conséquence, la nutrition des plantes dépend fortement de l'anatomie des racines.
L'endoderme, la couche de cellules corticales la plus interne entourant le système vasculaire central, a été considéré comme jouant un rôle central dans la nutrition des plantes en formant une barrière sélective pour l'eau et les nutriments depuis sa description il y a 150 ans (1865) par Robert Caspary.
Cette fonction a été corroborée par plusieurs analyses anatomiques et physiologiques chez diverses espèces végétales, mais reposait principalement sur des preuves corrélatives, car des mutants spécifiques de barrières endodermiques n'étaient disponibles que récemment. Ces dernières années, des efforts pour identifier de tels mutants ont été poursuivis afin de déchiffrer le réseau génétique contrôlant la différenciation endodermique. L'identification de gènes, mutants et marqueurs chez Arabidopsis thaliana a donné des opportunités sans précédent pour aborder fonctionnellement le rôle de l'endoderme. Dans cet article, sont présentes les avancées récentes de la différenciation de l'endoderme, sa fonction de barrière et sa plasticité à l'environnement.
Différenciation endodermique
Chez Arabidopsis (les arabettes), les cellules endodermiques proviennent de la division périclinale des cellules initiales cortex-endoderme. Cette division donne naissance à l'endoderme en tant que couche cellulaire corticale la plus interne. Dans de nombreuses espèces végétales, cependant, le cortex se compose de plusieurs fichiers cellulaires, ce qui entraîne un schéma de division complexe des cellules initiales.
Chez le riz, par exemple, l'endoderme provient de divisions périclinales séquentielles des cellules initiales épiderme-endoderme, générant l'épiderme, les multiples couches de cellules corticales et l'endoderme. De plus, de nombreuses espèces végétales développent non seulement un endoderme, mais aussi un exoderme, appelé couche cellulaire corticale la plus externe sous l'épiderme avec laquelle il partage des caractéristiques communes. En conséquence, de nombreuses caractéristiques endodermiques décrites dans cet aperçu peuvent également être liées à l'exoderme, mais ne seront pas discutées en détail.
L'endoderme subit plusieurs degrés de différenciation avec la formation de bandes de Caspery, le dépôt de lamelles de subérine comme dépôt secondaire de la paroi cellulaire et l'épaississement de la paroi cellulaire tertiaire.
Dans cet aperçu, les états I et II de différenciation endodermique se réfèrent à un endoderme portant uniquement des bandes caspariennes et à un endoderme avec des bandes caspariennes et des lamelles de subérine, respectivement.
Bandes caspariennes
Les bandes caspariennes sont des structures lignifiées déposées dans les parois anticlinales des cellules endodermiques. Les micrographies électroniques montrent que les bandes caspariennes relient étroitement les cellules endodermiques adjacentes et, à leur tour, scellent l'espace apoplastique (apoplaste). Les bandes caspariennes sont établies une fois que les cellules sont complètement allongées, formant initialement des plaques alignées de lignine (stade de la chaîne de perles), qui fusionnent plus tard pour former un anneau continu.
Chez Arabidopsis, le facteur de transcription MYB36 s'est récemment révélé être un régulateur majeur pour la transition d'un endoderme indifférencié à un état I. MYB36 contrôle directement et positivement l'expression des principaux gènes impliqués dans la formation des bandes caspariennes. Les mutants myb36 correspondants manquent de bandes caspariennes correctement localisées et déposent à la place de la lignine de manière ectopique dans les coins externes des cellules endodermiques et de la subérine près du méristème racine. La formation de la bande casparienne est initiée par la localisation des protéines du domaine de la bande de Caspery (CASP1-CASP5) sur le site de la formation de la bande casparienne (domaine de la bande casparienne, CSD) Les analyses de co-localisation dans les mutants et les lignées affectées dans l'accumulation de CASP au CSD suggèrent que les CASP recrutent la Péroxydase-64 (PER64), la protéine de domaine dirigent enhanced subérine 1 (ESB1), et potentiellement d'autres protéines sécrétées dans le CSD pour un dépôt localisé de lignine et fusion en un anneau.
L'expression des CASP, PER64 et ESB1 est directement contrôlée par MYB36. Fait intéressant, les mutants casp1-casp3 et esb1 présentent des phénotypes similaires avec des bandes caspariennes interrompues, compensées plus tard par un dépôt ectopique de lignine autour du CSD et un dépôt ectopique de subérine près du méristème. La kinase Schengen3 (SGN3, également connue sous le nom de GASSHO1), riche en leucine, est requise pour la formation normale de bandes caspariennes de manière indépendante de MYB36. SGN3 se localise autour des bandes caspariennes en formation et sa perte de fonction se traduit par des bandes caspariennes interrompues sans lignification ectopique et subérisation compensatoires. De manière surprenante, le dépôt ectopique de lignine et de subérine observé chez les mutants casp1-casp3 et esb1 dépend du SGN3, ce qui indique un rôle pivot du SGN3 dans cette compensation.
Lamelles de subérine
L'état II de différenciation endodermique est caractérisé par des lamelles de subérine, un dépôt de paroi cellulaire secondaire, qui se forme à la surface interne des parois cellulaires primaires recouvrant finalement toute la surface des cellules endodermiques. La subérine est un polymère hydrophobe constitué principalement de polyesters aliphatiques, qui forment le principal constituant du liège.
La transition de l'état I à l'état II de la différenciation endodermique commence sporadiquement en forme de patch. Il a été démontré que la signalisation de l'acide abscissique (ABA) régule la subérisation dans des conditions non stressantes. Le réseau de régulation contrôlant la transition de l'état I à l'état II est cependant encore largement inconnu. Le facteur de transcription MYB41 représente un bon candidat, car son expression ectopique s'est avérée suffisante pour induire une subérisation mais son rôle dans le développement endodermique reste incertain.
La biosynthèse des subérines implique une multitude d'enzymes. Les ω-hydroxylases (hydrolases des tissus de sous-racines, horst) et l'hydroxylase végétale aliphatique de racine (RALPH) appartenant à la sous-famille CYP86 des monooxygénases du cytochrome P450 et le glycérol-3-phosphate SN2-acyltrase 5 ont été particulièrement bien caractérisés pour Arabidopsis. Après la biosynthèse dans la cellule, les constituants de la subérine doivent être exportés vers l'espace extracellulaire pour former des lamelles de la subérine.
Cette exportation de subérine, cependant, est encore mal décrite et est considérée comme médiée par un transporteur et / ou dépendante de l'exocytose. Il a été démontré que les transporteurs dépendants de l'ATP de type ABC ABCG2, ABCG6 et ABCG20 sont impliqués dans ce processus. Dans le triple mutant correspondant abcg2-abcg6-abcg20, les changements dans la proportion de divers constituants monomères de la subérine sont en corrélation avec une formation incomplète de la subérine.
L'endoderme comme barrière
L'eau et les nutriments entrant dans la racine sont transportés par une combinaison de trois voies :
- la voie apoplastique, où les solutés diffusent librement dans l'espace apoplastique,
- la voie symplastique médiée par les connexions plasmodésmatiques entre les cellules adjacentes, et,
- la voie transcellulaire couplée (paracellulaire) où les porteurs polarisés d'influx et d'efflux transportent les solutés de manière vectorielle.
Les barrières endodermiques :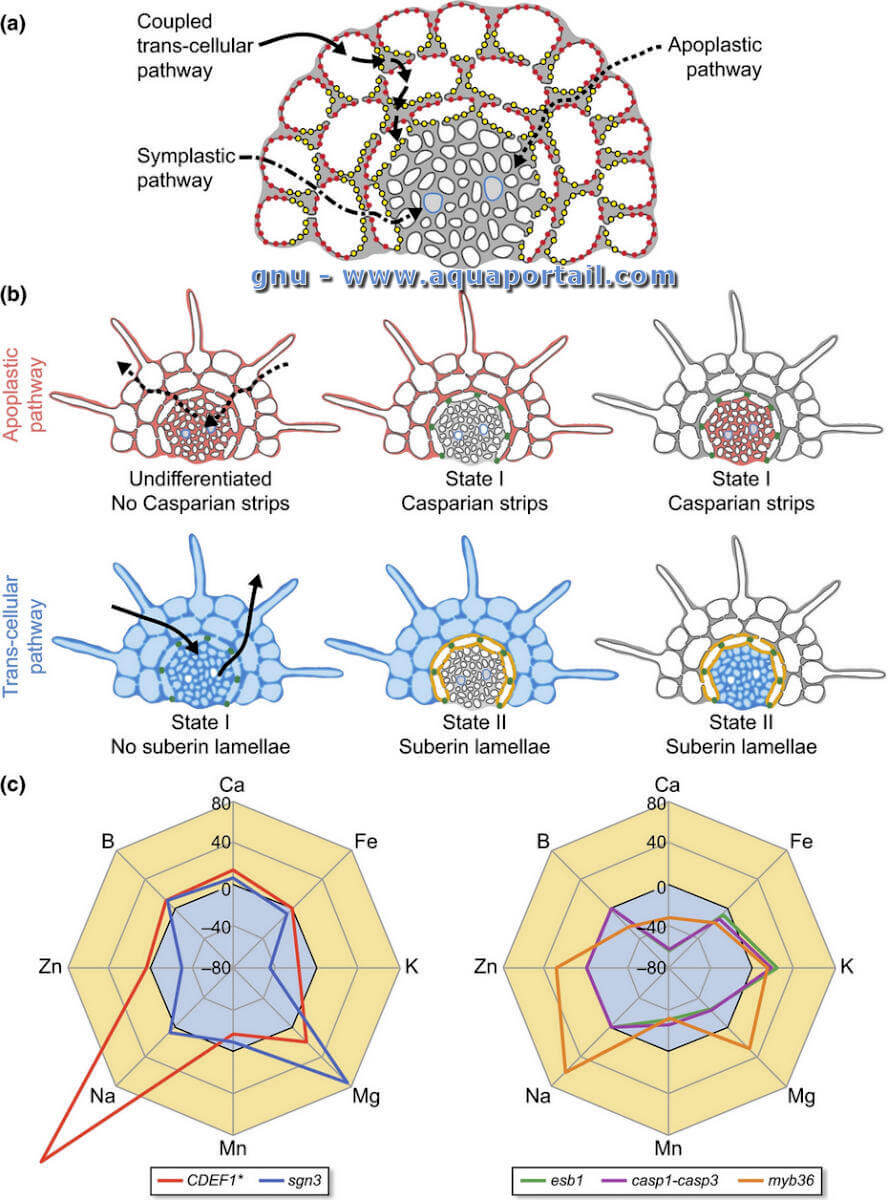
Les barrières endodermiques. (a) Vues schématiques des trois voies de transport radial des nutriments à travers les couches de cellules racinaires : voies transcellulaires apoplastiques, symplasiques et couplées, coexistant avant la différenciation de l'endoderme. Les points rouges et jaunes représentent respectivement les vecteurs d'afflux et d'efflux localisés de manière polaire. (b) Vues schématiques des voies apoplastiques et transcellulaires et de leur modulation par des bandes caspariennes et des lamelles subérines (panneaux supérieur et inférieur, respectivement). Les flèches illustrent le transport bidirectionnel de l'eau et des nutriments à travers l'endoderme. Les zones rouges et bleues représentent respectivement les voies apoplasiques et transcellulaires et l'effet des barrières endodermiques sur la compartimentation de la racine. (c) Vue d'ensemble de l'analyse ionomique réalisée chez les mutants et lignées Arabidopsis altérées dans la différenciation de l'endoderme (présenté sur la figure 1b). Les résultats sont présentés sous forme de pourcentage de différence par rapport aux plantes de type sauvage (WT). Les différences ont été calculées en moyenne à partir des résultats publiés précédemment pour les mutants individuels.
Barrière apoplastique
Depuis leur découverte, les bandes caspariennes ont été considérées comme formant une barrière bloquant la libre diffusion de l'eau et des nutriments présents dans l'espace apoplastique. Cette propriété de formation d'une barrière apoplastique avait déjà été étudiée en 1910 par de Rufz de Lavison qui étudia la pénétration des sels dans les racines des plantes et observa que de nombreux sels devaient entrer dans le symplasme de l'endoderme afin d'atteindre le système vasculaire central. Plus tard, plusieurs études ont montré que les colorants fluorescents ou les ions diffusant dans la racine sont bloqués au niveau des bandes caspariennes.
Récemment, l'iodure de propidium (IP) a été utilisé dans Arabidopsis comme traceur apoplastique permettant la coloration de montage entier de racines vivantes pour évaluer l'établissement et la fonctionnalité des bandes caspariennes. En conséquence, une voie purement apoplastique de la rhizosphère au système vasculaire central est considérée comme se produisant uniquement avant la différenciation de l'endoderme ou aux sites où les bandes caspariennes sont interrompues, comme lors de l'émergence latérale des racines.
Jusqu'à récemment, le rôle des bandes caspariennes en tant que barrière pour les nutriments était mal étayé par des preuves fonctionnelles. Au cours des dernières années, les travaux réalisés dans le groupe de Niko Geldner ont conduit à la caractérisation de mutants affectés dans la différenciation des bandes caspariennes. Il est intéressant de noter que les mutants affectés dans la différenciation des bandelettes caspariennes ont également été identifiés indépendamment grâce à une analyse ionomique par le groupe de David Salt, indiquant un rôle central de l'endoderme dans la nutrition des plantes.
Les collaborations entre les groupes de Niko Geldner et de David Salt ont conduit à une meilleure compréhension de la différenciation et de la fonction de l'endoderme. Cela s'applique en particulier aux mutants esb1 et casp1-casp3 identifiés à l'origine comme des mutants présentant une subérisation et une lignification améliorées, respectivement. Étonnamment, esb1 et casp1-casp3 se sont avérés avoir des phénotypes ionomiques similaires, ce qui a conduit à une observation plus attentive de ces mutants et à la découverte qu'ils ont des bandes caspariennes et des défauts de subérine similaires. Cependant, si esb1 et casp1-casp3 représentaient un point de départ pour aborder le rôle des bandes caspariennes dans la nutrition des plantes, leurs phénotypes ionomiques sont difficiles à interpréter car les bandes caspariennes ne sont retardées que chez ces mutants et accompagnées d'une subérisation ectopique.
Par conséquent, le mutant sgn3 affichant des bandes caspariennes interrompues associées à une barrière apoplastique non fonctionnelle (telle que notée par l'absorption de PI dans la stèle le long de la racine entière) et aucun défaut concernant la subérisation représente un outil prometteur. L'analyse économique des feuilles de sgn3 a révélé des changements modérés dans l'accumulation de nutriments, se manifestant principalement par une augmentation du magnésium et une diminution de l'accumulation de zinc et de potassium associée au phénotype de carence en potassium.
Ces résultats illustrent une propriété fondamentale mais souvent négligée de l'endoderme en tant que barrière bidirectionnelle, empêchant non seulement les solutés d'entrer dans le système vasculaire central, mais empêchant également la fuite des solutés accumulés de la stèle.
Barrière transcellulaire
Les lamelles subérines se développent après les bandes caspariennes et ne sont pas nécessaires pour établir une barrière apoplastique. Ceci est particulièrement bien démontré par l'analyse des lignées exprimant la cutinase CDEF1 dans leur endoderme, entraînant un dépôt de subérine non détectable sans affecter l'établissement de la barrière apoplastique. De plus, l'analyse des mutants affectés dans la formation de bandes caspariennes a démontré que la subérisation et l'établissement d'une barrière apoplastique ne sont pas corrélés.
En conséquence, le rôle précis de la subérine en tant que barrière fait l'objet de débats depuis quelques années; cependant, il a été suggéré de bloquer l'absorption d'eau et de nutriments de l'apoplaste vers le cytoplasme endodermique. Ce rôle de la subérine a été démontré récemment en analysant la pénétration d'un traceur cellulaire fluorescent (di‐acétate de fluorescéine, FDA) dans les racines subérisées et non subérisées. Il est intéressant de noter que le déchargement du carboxyl-FDA du phloème apparaît dans les cellules du péricycle, mais est bloqué au niveau de l'endoderme différencié illustrant la fonction de la subérine comme barrière bidirectionnelle.
La subérine a été associée à la résistance au stress salin et s'est avérée importante pour la croissance dans des conditions saturées d'eau dans le riz. Avec Arabidopsis, l'analyse des mutants a démontré qu'une subérisation réduite conduit à une augmentation du transport de l'eau, ainsi qu'à une accumulation et une sensibilité au sel plus élevées. L'analyse économique des plantes non subérisées (CASP1 :: CDEF1 et ELTP :: CDEF1) a de nouveau révélé des changements modérés mais spécifiques dans l'accumulation de nutriments, entraînant principalement une augmentation de la teneur en magnésium, calcium et sodium, et une diminution du potassium, associée à une plus grande sensibilité au sel et au potassium carence. Il est intéressant de noter que l'analyse ionomique des mutants esb1, casp1-casp3 et myb36 a révélé qu'une subérisation accrue entraîne une augmentation du potassium et une diminution de l'accumulation de manganèse et de calcium.
Dans l'ensemble, ces analyses ionomiques suggèrent que la subérine affecte le transport du potassium et du calcium de manières opposées, probablement en empêchant les fuites de potassium de la stèle et en empêchant l'afflux de calcium, comme suggéré précédemment. Une analyse plus approfondie de ces mutants, en particulier avec la mesure de l'influx et de l'efflux et/ou l'imagerie des nutriments dans des sections de racines subérisées ou non, sera d'un intérêt crucial pour tester ce modèle.
Plasticité endodermique aux nutriments
Les bandes caspariennes et la formation de lamelles de subérine sont fortement régulées par les conditions environnementales. Dans le maïs, par exemple, il a été démontré que le sel affecte le développement et la largeur des bandes caspariennes. Plus généralement, le passage d'un endoderme de l'état I à l'état II semble être fortement modulé par une large gamme de stress abiotiques. Dans le riz, par exemple, le dépôt de subérine est induit par le stress de la sécheresse, la saturation en eau et le sel. Récemment, dans le maïs, le développement de la subérine a été induit unilatéralement du côté des racines exposées à l'air ou en contact avec le cadmium. Cette plasticité endodermique suggère une stratégie végétale pour réduire l'entrée d'éléments toxiques tels que le cadmium et le sel, et pour empêcher les fuites d'eau et d'oxygène en cas de sécheresse et de saturation en eau.
La plasticité de l'endoderme :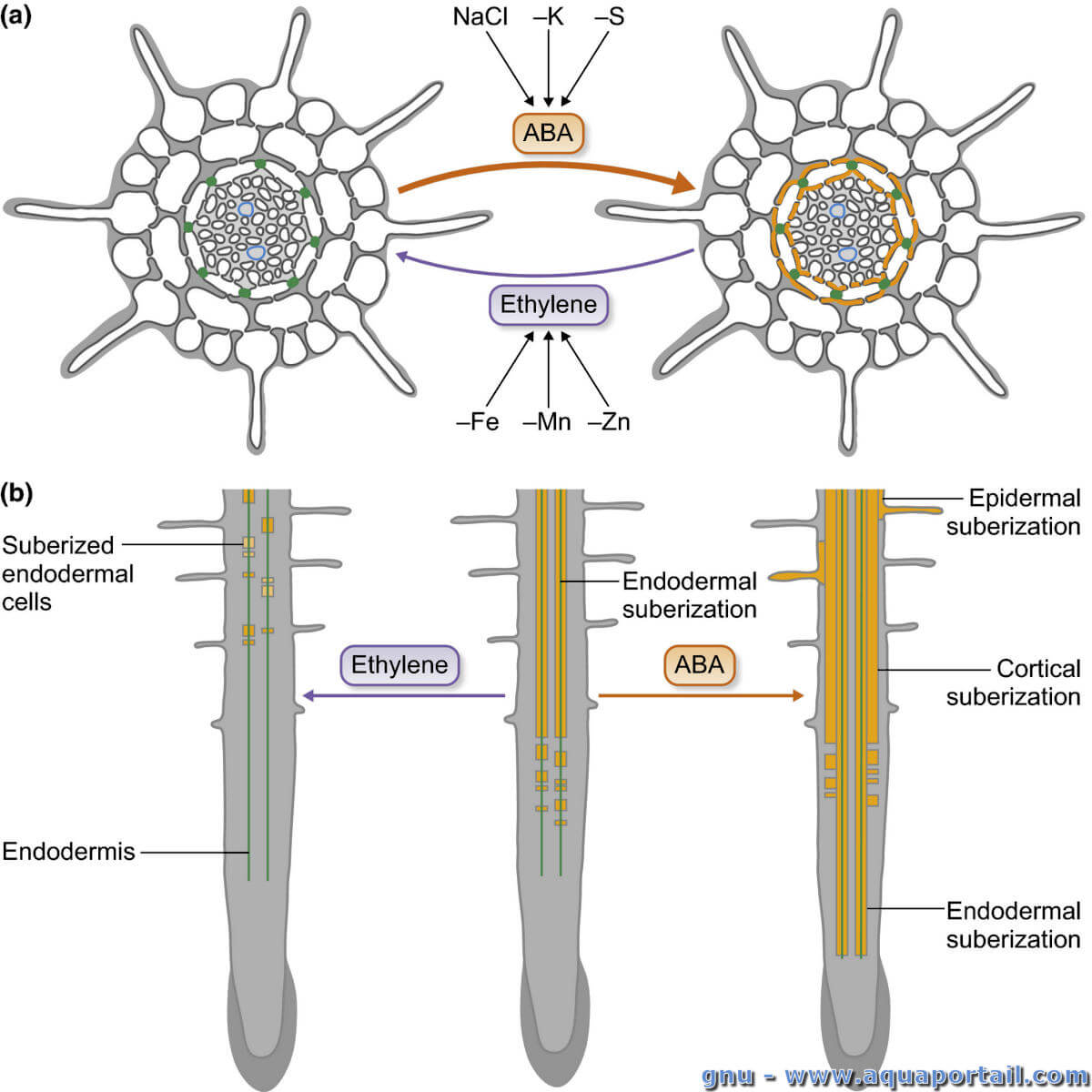
Plasticité de l'endoderme avec représentations schématiques des effets antagonistes de l'acide abscissique (ABA) et de l'éthylène sur la subérisation endodermique dans les racines d'Arabidopsis. (a) Effet des nutriments sur la subérisation endodermique. Les carences en NaCl, K et S entraînent une augmentation de la subérisation, tandis que les déficiences en Fe, Mn et Zn entraînent une réduction de la subérisation par l'effet antagoniste de l'ABA et de l'éthylène, respectivement. (b) Effets de l'ABA et de l'éthylène sur la subérisation présentés dans des vues longitudinales. L'éthylène conduit à une réduction de la subérisation endodermique alors que l'ABA conduit à la subérisation ectopique, à proximité du méristème racinaire et dans les couches cellulaires corticales et épidermiques.
Chez Arabidopsis, la plupart des gènes contrôlant la subérisation ont été induits par l'ABA et/ou le traitement au sel. Récemment, la subérisation s'est avérée régulée par un large éventail d'indices nutritionnels : les carences en fer, en manganèse et en zinc entraînent une réduction de la subérisation, tandis que les carences en soufre et en potassium entraînent une augmentation de la subérisation. Ce niveau élevé de plasticité de la subérine suggère une stratégie de la plante pour faire face aux disponibilités en nutriments en modulant leur absorption ou leur rétention dans le système vasculaire. S'adaptant à ce modèle, la subérisation réduite par l'expression de CDEF1 restaure la croissance et le développement du mutant d'absorption de fer irt1, conduit à une carence en potassium dans le type sauvage (WT) et améliore les phénotypes de carence en soufre du mutant d'absorption de sulfate sultr1; 1-sultr1; 2.
La plasticité des subérines est étroitement contrôlée par l'action antagoniste de l'ABA et de l'éthylène conduisant à une subérisation ectopique ou réduite. Il est intéressant de noter que la réduction de la subérisation lors d'une carence en fer, en manganèse et en zinc est contrôlée par la signalisation de l'éthylène, tandis que la subérisation induite lors du traitement au sel et de la carence en soufre et potassium est contrôlée par la signalisation ABA endodermique. Cependant, la détection initiale de la disponibilité des nutriments, qui déclenche ensuite des réponses médiées par l'ABA et l'éthylène, est restée jusqu'à présent inconnue. De plus, les acteurs moléculaires en aval de ces hormones, qui contrôlent transcriptionnellement la biosynthèse et la dégradation de la subérine, doivent encore être identifiés.
Conclusions
Des progrès récents dans la caractérisation des acteurs moléculaires contrôlant la différenciation endodermique ont conduit à l'identification de mutants et de lignées transgéniques affectées dans la formation de lamelles de la bande casparienne et de la subérine. Leur caractérisation par des approches ionomiques et physiologiques pointe vers un rôle central des barrières endodermiques dans le contrôle de l'absorption des nutriments et de leur translocation vers les parties aériennes de la plante.
De plus, la subérisation est étroitement contrôlée par des signaux nutritionnels et hormonaux modulant l'acquisition des nutriments et représentant la stratégie d'une plante pour faire face à son environnement. L'observation selon laquelle la signalisation ABA endodermique est déterminante pour contrôler la subérisation en réponse aux stress abiotiques indique que l'endoderme joue un rôle clé dans l'intégration des signaux nutritionnels et hormonaux, et pose la question de son rôle dans la détection des nutriments. Une compréhension plus approfondie de la plasticité de la subérine et de sa fonction dans l'adaptation d'une plante à son environnement sera fondamentale pour établir la subérisation comme un trait précieux pour l'amélioration des cultures. En particulier, il serait intéressant d'étudier plus en détail la formation et la plasticité des subérines chez d'autres espèces végétales et de tester si le réseau de régulation décrit avec Arabidopsis est également applicable aux cultures.