Catalyseur
Définition
Un catalyseur est une substance qui augmente la vitesse d'une réaction chimique sans être consommée et sans modifier la position finale de l'équilibre thermodynamique de cette réaction.
Les meilleurs catalyseurs sont des matériaux qui peuvent accélérer la réaction tout en restant neutres. L'inverse d'un catalyseur est un inhibiteur.
Un catalyseur d'eau :
Structure d'une catalyseur de l'eau : du métaphosphate de NaCo (PO3)3 avec une vue élargie des blocs de construction [CoO6] octaèdres et tétraèdres [PO4].
Explications
En chimie, un catalyseur est une substance capable d'accélérer ou de faciliter une réaction chimique, la catalyse, sans entrer dans la composition du produit obtenu. Il accélère la réaction en va et vient de la même manière et modifie ainsi la cinétique des réactions chimiques, pas leur thermodynamique.
Un catalyseur participe à une réaction chimique pour former une étape intermédiaire avec les réactifs, à partir duquel le catalyseur est libéré sans modification lors de la formation du produit. Un catalyseur peut traverser plusieurs fois ce cycle dit catalytique.
En fonction des phases dans lesquelles le catalyseur et les réactifs sont présents, on parle de catalyseurs homogènes ou catalyseurs hétérogènes. Les processus biochimiques sont catalysés par des enzymes (catalyse enzymatique). L'inverse d'un catalyseur est un inhibiteur; par exemple, l'inhibiteur de croissance réduit l'activité des catalyseurs.
Par définition, un catalyseur est la substance qui effectue la catalyse. Les catalyseurs sont utilisés dans la protection de l'environnement fixe et mobile, dans l'industrie chimique et dans la technologie de raffinage. En 2008, les ventes de catalyseurs d'échappement ont atteint environ 5,2 milliards de dollars. L'autocatalyseur représentait la plus grande part du marché des catalyseurs hétérogènes.
Les catalyseurs pour les applications environnementales stationnaires, tels que les catalyseurs DENOX, ont vendu environ 1 milliard de dollars dans le monde. Environ 30 % du marché repose sur des catalyseurs pour des processus de raffinage tels que la plate - forme et le craquage de catalyseur, et 30 % sont utilisés dans l'industrie chimique dans divers procédés.
L'efficacité ou l'activité d'un catalyseur est exprimée par le nombre de chiffres d'affaires, également appelé nombre de retournements, ou par le nombre de cycles par unité de temps, la fréquence de retournement.
Une autre propriété essentielle d'un catalyseur est sa sélectivité, c'est-à-dire sa capacité à ne faire qu'accélérer les réactions souhaitées, mais à éviter la génération de sous-produits indésirables.
Souvent, un cycle catalytique nécessite, en plus du catalyseur lui-même, un cocatalyseur qui influence positivement l'activité ou la sélectivité d'un catalyseur. Un exemple bien connu est la fonction du méthylaluminoxane en tant que co-catalyseur dans la polymérisation des oléfines et de l'acide iodhydrique dans le procédé Monsanto.
Exemples de catalyseurs
La pierre à briquet ou ferrocérium (synthèse d'ammoniac), nickel de Raney, platine, rhodium, palladium, dioxyde de manganèse, pentoxyde de vanadium et oxyde de samarium (III) catalysent la déshydrogénation de l'éthanol.
La hopcalite, un groupe de catalyseurs dérivés de divers oxydes métalliques, catalyse l'oxydation du monoxyde de carbone en dioxyde de carbone à la température ambiante.
Convertisseur catalytique de véhicule : L'exemple le plus connu est le catalyseur utilisé dans l'automobile pour la réduction des émissions d'échappement, dans lequel l'ensemble du dispositif est nommé d'après le principe physico-chimique.
Réchauffeur de charbon actif : le sel et l'eau servent de catalyseurs. Il sert de chauffe-main.
Chimie
Le mode d'action d'un catalyseur est basé sur sa capacité à modifier le mécanisme d'une réaction chimique de telle sorte que l'énergie d'activation est modifiée. On "va autrement" sur le potentiel - hyperplan.
Le potentiel est généralement fonction de plusieurs variables. Par conséquent, dans le cas le plus simple, le potentiel dépend de deux variables seulement qui changent, le potentiel est un plan tridimensionnel. Les variables peuvent z. Par exemple, il peut y avoir deux distances de liaison entre les réactifs qui changent pendant la réaction. Ce cas le plus simple est frappant mais irréaliste.
Cela intervient via la formation d'un intermédiaire réactif et sa réaction aux produits finaux, le catalyseur utilisé étant reformé. En pratique, les catalyseurs sont rendus inefficaces par des réactions secondaires après un certain temps d'utilisation, car ils sont bloqués par des sous-produits.
On peut citer à titre d'exemple la combustion catalytique de l'hydrogène avec de l'oxygène. Cette combustion est thermodynamiquement si favorable qu'elle devrait en principe être "volontaire", mais du fait de la forte énergie d'activation à la température ambiante, elle est si fortement inhibée que le taux de réaction est très faible.
La présence d'un catalyseur au platine peut réduire cette énergie d'activation de sorte que cette réaction se déroule suffisamment rapidement à des températures plus basses. Le briquet Döbereiner en était une application.
Dans les réactions à l'équilibre, un catalyseur modifie la réaction en arrière de la même manière, de sorte que la position à l'équilibre ne change pas, mais que l'équilibre soit réglé plus rapidement.
Voir aussi la catalyse enzymatique, la catalyse homogène et la catalyse hétérogène. Un catalyseur zymotique est propre à faire fermenter, est relatif à la fermentation. Voir la zymotechnie.
Lorsqu'un catalyseur est impliqué dans la collision entre des molécules de réactif, il faut moins d'énergie pour que le changement chimique survienne, et donc plus de collisions ont assez d'énergie pour que la réaction intervienne. La vitesse de réaction augmente donc également. La théorie des collisions est étroitement liée à la cinétique chimique.
Production de catalyseurs hétérogènes
L'efficacité des catalyseurs hétérogènes dépend essentiellement du nombre de contacts possibles simultanément entre le catalyseur et les substrats, pour lesquels la plus grande surface de catalyseur possible est souvent importante.
Les catalyseurs hétérogènes peuvent être présents sous forme de contacts complets non poreux ou de réseaux métalliques, comme dans le procédé d'Ostwald avec des surfaces spécifiques faibles ou sous la forme d'un solide poreux avec une surface spécifique élevée.
Des contacts complets peuvent être établis, par exemple, par précipitation ou co-précipitation de sels métalliques par des carbonates ou des hydroxydes alcalins. Ceux-ci sont lavés après la précipitation, séchés, calcinés et éventuellement activés par réduction en métal.
La catalyse des réactions d'oxydation nécessite souvent des contacts complets, qui ont le composant actif uniquement dans la région externe du corps du catalyseur et permettent une diffusion rapide des réactifs à partir du flux de gaz principal et dans celui-ci, étape limitante de ces réactions.
Les catalyseurs hétérogènes sont produits de nombreuses manières différentes. Un procédé connu est l'extrusion pour produire des catalyseurs pour l'autocatalyseur qui est ensuite revêtu par lavage. Un contact poreux est constitué soit d'un matériau solide tel que l'alumine, soit d'un matériau porteur imprégné ou revêtu d'un composant catalytiquement actif et éventuellement d'activateurs.
Un aspect important des contacts poreux est la distribution des tailles de pores. Les pores dans le grain du catalyseur augmentent considérablement la surface spécifique. Cela peut représenter plusieurs centaines de mètres carrés par gramme.
Selon la définition de l'IUPAC, on distingue trois gammes de tailles de pores : les micropores de diamètre inférieur à 2 nm, les mésopores de 2 à 50 nm et les macropores supérieurs à 50 nm. Pour la conception du catalyseur, il est important que la distribution de la taille des pores corresponde à la diffusion et à la vitesse de réaction de la réaction.
Après l'imprégnation d'un support avec une solution de sel métallique, par exemple, le séchage, la calcination et l'activation du métal ont lieu. Les conditions spécifiques de ces étapes peuvent permettre d'ajuster des profils métalliques spécifiques sur une pastille de support en fonction de la cinétique de réaction et des caractéristiques de diffusion des réactifs de la réaction catalysée.
Les matériaux de support portent en catalyse hétérogène les amas de métaux catalytiquement actifs finement divisés et peuvent servir de co-catalyseur en raison de leurs propriétés, ou ils ont une influence de ligand sur l'activité catalytique du métal dispersé. Dans les matériaux microporeux tels que les zéolithes, l'échange d'ions a fait ses preuves.
Par des structures spéciales, par exemple dans les zéolithes, les matériaux de support peuvent influer sur la sélectivité d'une réaction. Des exemples de matériaux de support sont la cordiérite, le noir de carbone, le gel de silice, les zéolites ou les oxydes métalliques tels que le dioxyde de titane et l'oxyde d'aluminium.
Préparation de catalyseurs homogènes à métaux de transition
En chimie organométallique, la préparation de catalyseurs à base de métaux de transition homogènes est souvent effectuée par les méthodes de la chimie organométallique. De nombreux catalyseurs à base de métaux de transition sont sensibles à l'air et à l'humidité.
La conception du ligand pour le rendement et la sélectivité de la réaction catalysée par un homogène revêt une importance particulière. Les propriétés électroniques et stériques du ligand peuvent contrôler la réaction et, par exemple, transférer des informations stériques au système réactif.
Désactivation et régénération de catalyseur
Les mécanismes de désactivation du catalyseur sont multiples. Dans la catalyse des métaux de transition, par exemple, on observe la réduction des catalyseurs métal-ligand utilisés sur le métal.
En gros, le type de désactivation peut être classé en mécanique, par exemple par abrasion ou décroissance, thermique comme par frittage, physique comme la cokéfaction ou le blocage physique de centres actifs et la désactivation chimique par formation de composants métalliques inactifs tels que des sulfures.
En catalyse hétérogène, par exemple dans les procédés de raffinage, la cokéfaction, le frittage de la surface active ou la décomposition du catalyseur par abrasion mécanique, par exemple dans le procédé à lit fluidisé connu. Les processus de vieillissement permettent de réduire la surface catalytiquement active ou d'obstruer les pores, par exemple dans les zéolithes.
Les processus de régénération comprennent, par exemple, la combustion de coke de contacts utilisés dans le craquage, le reformage catalytique ou l'oxychloration pour restaurer les sites acides. Si le catalyseur est désactivé jusqu'à ce que la régénération n'ait plus aucun sens, le catalyseur est déchargé du processus.
Pour les catalyseurs à base de métaux nobles, les supports sont éventuellement fondus et le métal précieux est récupéré par des procédés de fusion et électrochimiques.
La désactivation par transformations de phase est souvent irréversible. Ceci est observé par exemple dans les catalyseurs zinc/alumine pour la synthèse du méthanol exposés à des températures élevées. En formant une phase spinelle, le catalyseur est désactivé et ne peut pas être régénéré.
Importance des catalyseurs
Les catalyseurs existent dans la nature de nombreuses manières. Chez les êtres vivants, presque toutes les réactions chimiques vitales sont catalysées (par exemple lors de la photosynthèse, de la respiration ou de la production d'énergie à partir d'aliments). Les catalyseurs utilisés sont généralement certaines protéines, telles que les enzymes.
La réduction de l'énergie d'activation par les catalyseurs revêt une grande importance commerciale dans les réactions chimiques. Actuellement, on estime qu'environ 80 % de tous les produits chimiques passent par une étape catalytique de leur chaîne de valeur.
Sans la présence du catalyseur, la réaction chimique respective serait beaucoup plus lente ou pas du tout. C'est pourquoi les catalyseurs d'aujourd'hui sont presque indispensables en génie chimique.
Si plusieurs produits sont formés dans des réactions, la sélectivité d'un catalyseur joue un rôle très important. Dans ce cas, le catalyseur est choisi pour que seule cette réaction soit accélérée, ce qui permet d'obtenir le produit souhaité. Les impuretés causées par les sous-produits sont en grande partie évitées.
Du point de vue de la protection de l'environnement, l'utilisation de catalyseurs sélectifs et actifs économise de l'énergie et réduit la quantité de sous-produits. Le traitement des gaz d'échappement dans la production industrielle ou dans les centrales électriques est tout aussi important pour l'environnement.
Dans le cas de procédés catalytiques sur les gaz d'échappement (par exemple dans les voitures), inévitables, les substances dangereuses sont converties en substances moins dangereuses.
Exemple : Dans l'autocatalyseur, le poison respiratoire fait réagir le monoxyde de carbone (CO) et les hydrocarbures non brûlés avec les NOx et l'oxygène (dioxygène O2) pour former du dioxyde de carbone (gaz carbonique CO2), de l'azote et de l'eau (eau pure H2O).
Synonymes, antonymes
Voir tous les synonymes pour "catalyseur".1 synonyme (sens proche) de "catalyseur" :
1 antonyme (sens contraire) :
- inhibiteur
Les mots ou les expressions apparentés à CATALYSEUR sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot CATALYSEUR est dans la page 2 des mots en C du lexique du dictionnaire.
Mots en C à proximité
catalase catalepsie catalyse catalyse hétérogène catalyse homogène catalyseurcatamorphisme cataphracte cataphylle Catappa catastrophe
En rapport avec "catalyseur"

La biocatalyse est le processus chimique par lequel des enzymes ou d'autres catalyseurs biologiques effectuent des réactions entre des composants organiques.
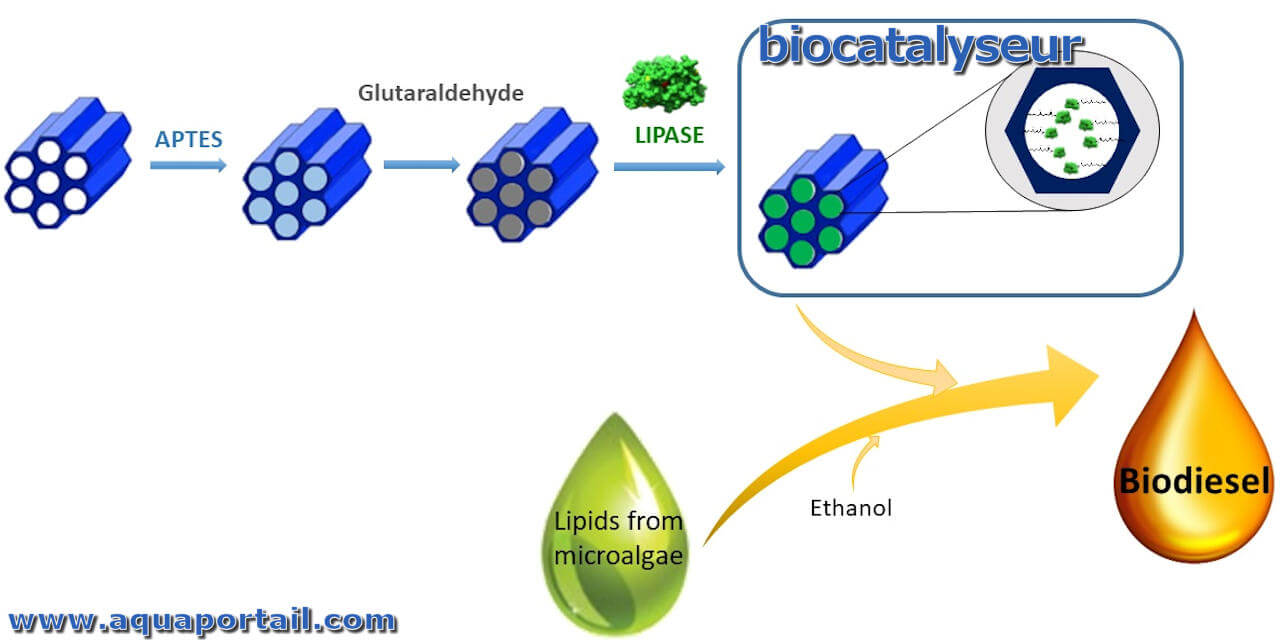
Un biocatalyseur est une macromolécule naturelle qui accélère une réaction biochimique. Les catalyseurs naturels (biologiques) sont, par exemples...
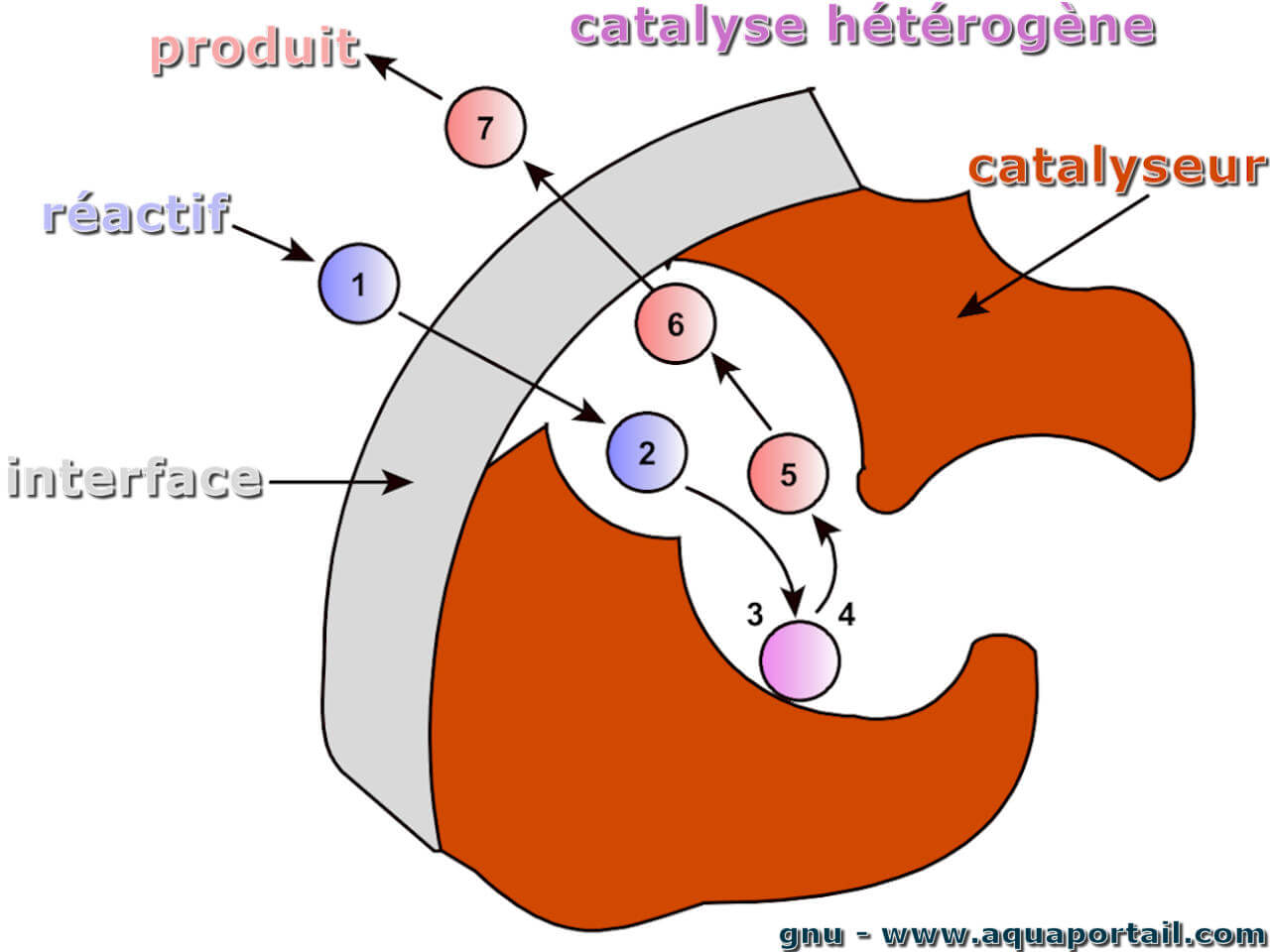
Une catalyse est un processus chimique qui consiste en l'accélération cinétique d'une réaction chimique grâce à une substance appelée catalyseur...

La catalyse hétérogène est une catalyse dans laquelle le catalyseur et les réactifs d'une réaction chimique sont présents en différentes phases (gazeuse...
