Catalyse hétérogène
Définition
La catalyse hétérogène est une catalyse dans laquelle le catalyseur et les réactifs d'une réaction chimique sont présents en différentes phases (gazeuse, liquide, solide non miscible). Dans les procédés industriels, le catalyseur hétérogène est généralement présent sous forme de solide, appelé contact, et les réactifs sont des gaz ou des liquides.
Les avantages de la catalyse hétérogène par rapport à la catalyse homogène sont la facilité de séparation du catalyseur des réactifs et des produits. De plus, elle permet de traiter facilement les catalyseurs désactivés.
Les étapes d'une catalyse hétérogène :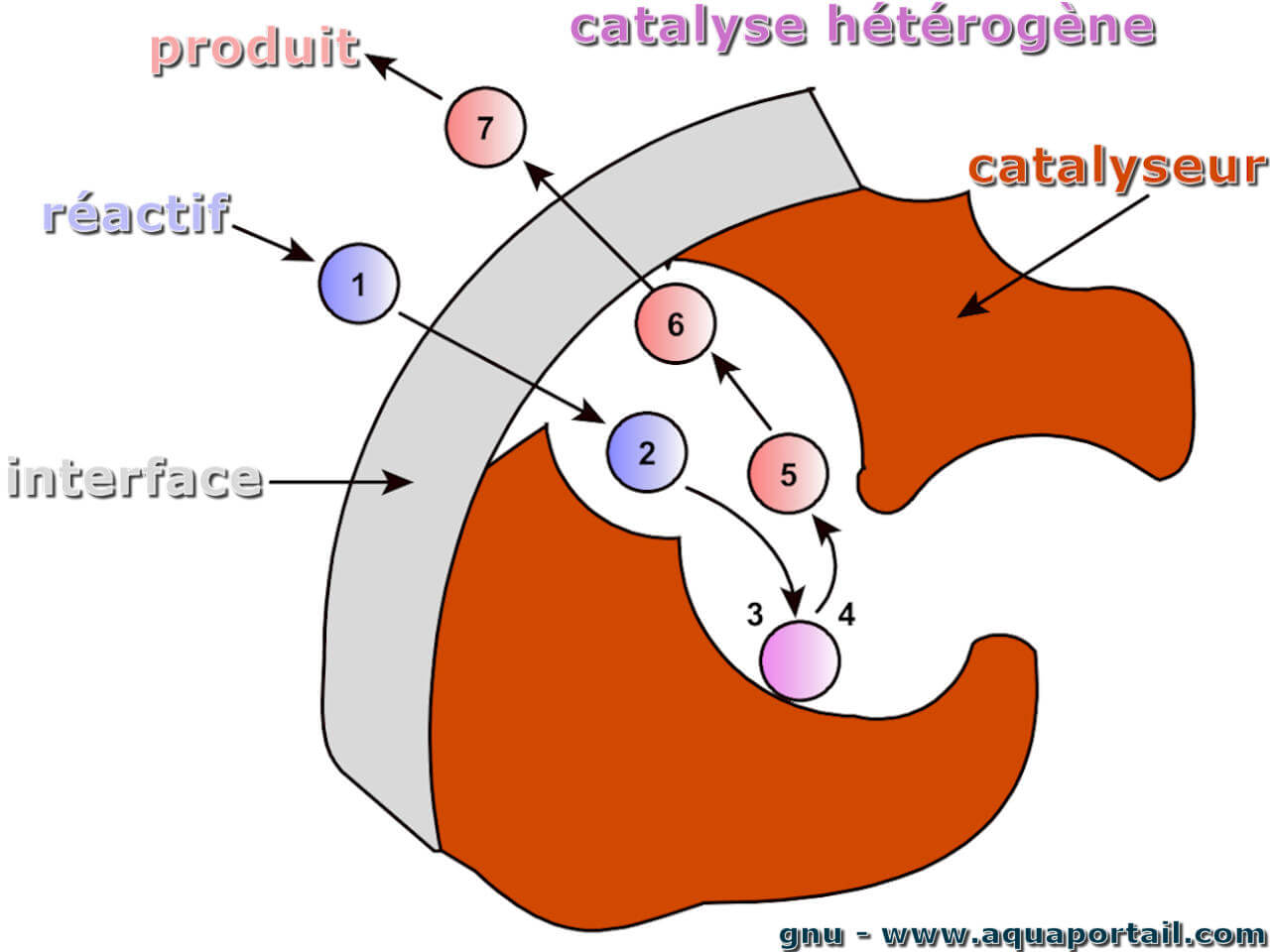
Les sept étapes de la catalyse hétérogène sur des catalyseurs poreux commencent par l'arrivée d'un réactif.
Explications
Les procédés catalytiques hétérogènes pour la fabrication de produits chimiques de base, tels que le processus de mise en contact pour la production d'acide sulfurique, le procédé Haber-Bosch pour la synthèse d'ammoniac ou la production de méthanol, ont joué un rôle décisif dans le succès commercial de l'industrie chimique. La synthèse Fischer-Tropsch de gaz de synthèse à partir de biomasse, de charbon ou de gaz naturel peut être utilisée pour obtenir des carburants de synthèse XtL et des matières premières oléfiniques pour l'industrie chimique.
Dans les raffineries de pétrole, les procédés catalytiques hétérogènes apportent une contribution importante à la production de carburants essence à indice d'octane élevé et d'autres composants hydrocarbonés précieux. En technologie environnementale, la catalyse hétérogène sert à maintenir l'air pur en réduisant et en éliminant les polluants des émissions des centrales électriques. Le développement et l'utilisation du catalyseur à trois voies ont permis de réduire considérablement les émissions de polluants des véhicules à moteur à essence lorsque le taux d'air de combustion était optimal.
Méthodes de production
L'état de la matière le plus couramment utilisé pour les catalyseurs hétérogènes est la forme solide. Dans ce cas, le catalyseur ou le contact est constitué entièrement du composant actif, appelé catalyseur solide, ou bien le composant actif est appliqué sur un matériau de support. Les paramètres de processus de la réaction chimique en cours imposent un certain nombre de contraintes aux propriétés physiques et chimiques des contacts. Le développement de catalyseurs doit donc fournir une méthode de préparation pratique fournissant les propriétés chimiques et physiques souhaitées des contacts. Les catalyseurs solides peuvent être largement distingués en catalyseurs en poudre, moulés, monolithes ou réseaux.
Construction de catalyseurs solides
En conjonction avec les conditions de la réaction technique, il faut essayer d'optimiser l'activité, la sélectivité et le rendement espace-temps du contact. Outre les propriétés chimiquement importantes du contact, celles-ci doivent répondre aux exigences du processus, telles que la capacité de régénération, la résistance à l'abrasion, la reproductibilité de la production doit être ajustable et la production au coût le plus bas possible.
Voir une précipitation chimique, une imprégnation, le dépôt chimique en phase vapeur et le procédé sol-gel.
Hétérogénéisation de catalyseurs homogènes
L'hétérogénéisation de catalyseurs homogènes tente de combiner les avantages de la catalyse homogène, tels qu'une sélectivité élevée et la disponibilité totale de l'espèce catalytiquement active, avec les avantages de la catalyse hétérogène, tels que la facilité de séparation du catalyseur et des réactifs.
L'hétérogénéisation de complexes de métaux de transition homogènes a généralement lieu en fixant les complexes solubles sur un support solide. La fixation peut être réalisée de manière covalente par modification des ligands complexes, mais une fixation ionique ou par adsorption est également possible. Dans le cas de solides poreux, une incorporation physique dans la structure poreuse du solide est possible. Des exemples montrent qu'une fixation trop forte entraîne une diminution de l'activité catalytique, tandis qu'une fixation trop faible entraîne un "saignement" ou une " lixiviation " du complexe hors du solide.
Une autre méthode est l'hétérogénéisation dans des systèmes liquide-liquide, dans laquelle le catalyseur de complexe métallique est soluble dans l'eau par modification de ligand et peut donc être facilement séparé de la phase organique résultante. Un exemple est l'hydroformylation selon le procédé Ruhrchemie / Rhône-Poulenc, dans laquelle le rhodium est complexé avec de la tri- (métasulfonatophényl-sodium) phosphine, qui possède des propriétés hydrophiles par la substitution du ligand par des groupes sulfonate. La réaction a lieu dans la phase aqueuse. La phase de produit organique est insoluble dans l'eau et est séparée par séparation de phases. La phase de catalyseur aqueuse est renvoyée dans le réacteur. Comme matières de départ, le propène et le gaz de synthèse, qui consiste en hydrogène et en monoxyde de carbone dans le rapport de 1,1 : 1 utilisé. Le procédé Ruhrchemie / Rhône-Poulenc est l'un des premiers systèmes à deux phases commercialisé dans lequel le catalyseur est en phase aqueuse.
Cinétique de la catalyse hétérogène
La catalyse hétérogène dans un grain de catalyseur poreux peut être subdivisée en sept sous-étapes, chaque étape pouvant limiter la vitesse. La première étape est la diffusion des éduits à la surface du contact à travers la couche limite stationnaire. L'épaisseur de la couche limite change avec la vitesse d'écoulement. La deuxième étape est la diffusion des éduits dans les pores du contact avec le centre catalytiquement actif.
Dans la troisième étape, l'adsorption des matériaux de départ a lieu au centre actif.Ceci est suivi de la quatrième étape, la réaction des réactifs à la surface. Une étape partielle possible de la catalyse hétérogène est le débordement. Dans ce cas, une espèce activée diffuse d'un centre catalytiquement actif vers un autre centre, qui diffère chimiquement du premier centre.
Maintenant, les produits sont transportés dans l'ordre inverse : dans la cinquième étape, les produits sont désorbés du centre actif. Ensuite, la sixième étape consiste à diffuser les produits à travers le système de pores du contact. Dans la septième étape, les produits diffusent à travers la couche limite dans le flux de gaz principal et sont transportés.
Comme pour toutes les réactions consécutives, seule l'étape élémentaire la plus lente est limitante.
Synonymes, antonymes
Voir tous les synonymes pour "catalyse hétérogène".1 synonyme (sens proche) de "catalyse hétérogène" :
1 antonyme (sens contraire) :
Les mots ou les expressions apparentés à CATALYSE HÉTÉROGÈNE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
L'expression CATALYSE HETEROGENE est dans la page 2 des mots en C du lexique du dictionnaire.
Mots en C à proximité
cataclysmique catadrome catalase catalepsie catalyse catalyse hétérogènecatalyse homogène catalyseur catamorphisme cataphracte cataphylle
En rapport avec "catalyse hétérogène"

La biocatalyse est le processus chimique par lequel des enzymes ou d'autres catalyseurs biologiques effectuent des réactions entre des composants organiques.
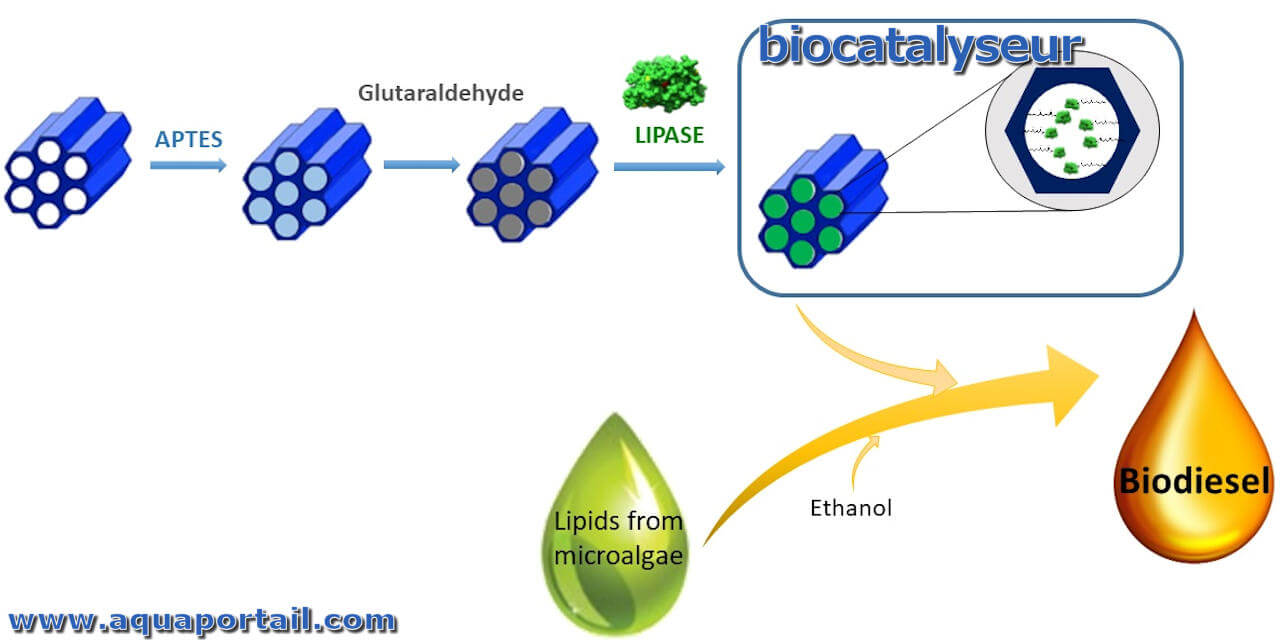
Un biocatalyseur est une macromolécule naturelle qui accélère une réaction biochimique. Les catalyseurs naturels (biologiques) sont, par exemples, les enzymes...

Une catalyse est un processus chimique qui consiste en l'accélération cinétique d'une réaction chimique grâce à une substance appelée catalyseur, qui ne subit...

La catalyse homogène est utilisée lorsque, au cours d'une réaction chimique, le catalyseur et les réactifs sont dans la même phase.
