Monoxyde de carbone
Définition
Le monoxyde de carbone, aussi appelé oxyde de carbone (II), gaz carboné et anhydride carboné (les deux derniers sont de plus en plus désaffectés), dont la formule chimique est CO, est un gaz incolore et hautement toxique. Il peut causer la mort en respirant à des niveaux élevés.
Il est produit par la combustion déficiente de substances telles que le gaz, l'essence, le kérosène, le charbon, l'huile, le tabac ou le bois. Les foyers, les chaudières, les chauffe-eaux ou les appareils de chauffage, ainsi que les appareils ménagers qui brûlent du combustible, comme les cuisinières ou les gazinières ou les appareils de chauffage au pétrole, peuvent aussi en produire s'ils ne fonctionnent pas bien. Les véhicules à moteur à explosion en produisent également.
Une molécule de monoxyde de carbone :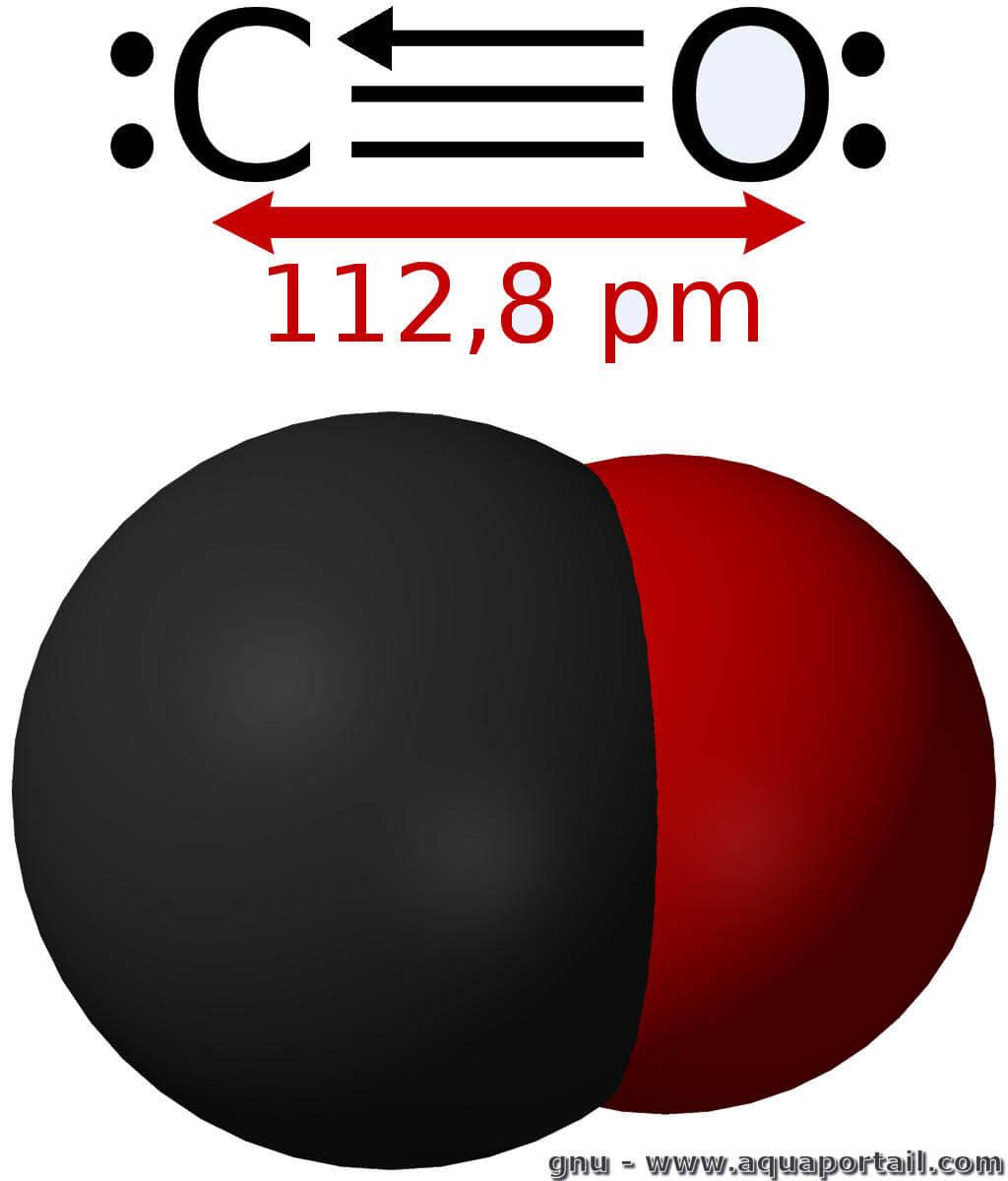
Le monoxyde de carbone est toxique, incolore et inodore. Cela le rend très dangereux. Le gaz est légèrement plus léger que l'air. Le nombre d'oxydation du carbone dans le monoxyde de carbone est +2, au lieu de +4 habituel. Il peut donc être encore oxydé en dioxyde de carbone et est donc combustible.
Explications
De grandes quantités de monoxyde de carbone sont formées en tant que sous-produits pendant les processus d'oxydation pour la production de produits chimiques, ce qui rend nécessaire la purification des gaz résiduaires. D'autre part, des efforts de recherche considérables sont déployés pour développer de nouveaux procédés et des catalyseurs pour la maximisation de la production du produit utile. Il peut également être trouvé dans les atmosphères d'étoiles de carbone.
Le monoxyde de carbone est un gaz incolore qui est causé, entre autres, par une combustion incomplète du carbone, des combustibles fossiles ou d'autres composés carbonés combustibles (la plupart des composés organiques).
Structure et propriétés
La structure de la molécule est par définition linéaire (le monoxyde de carbone est, après tout, diatomique) et est mieux décrite à l'aide de la théorie de l'orbitale moléculaire. La longueur de la liaison (111 μm) indique qu'il y a un caractère de liaison triple. Le monoxyde de carbone a un petit moment dipolaire.
Le monoxyde de carbone a souvent causé des problèmes dans l'histoire de la description de la liaison chimique. Dans la théorie de Lewist, on partait de l'idée qu'il y avait une tendance à vouloir former un octet et que les liens provenaient de la nécessité de diviser les paires d'électrons entre les atomes pour satisfaire à cette règle de l'octet. Un total de 10 électrons de valence sont présents dans le monoxyde de carbone (4 de carbone et 6 d'oxygène). Cependant, le nombre d'électrons désirés (pour former 2 octets) est de 16, donc des charges formelles existeront dans la molécule. En 1919, Irving Langmuir a proposé une formule structurelle avec une triple liaison entre le carbone et l'oxygène. Chaque élément porte 1 paire d'électrons libres.
Le problème avec cette structure est que la charge formelle de carbone est ici -1 et d'oxygène +1. Cependant, ces frais formels sont à l'opposé de ce que l'on pourrait attendre sur la base de l'électronégativité : le carbone est plus positif que l'oxygène et tolère plus facilement une charge positive que négative. L'inverse s'applique à l'oxygène.
La première structure est celle proposée par Langmuir. La structure du milieu n'a pas de charges formelles et semble donc beaucoup plus plausible, mais l'atome de carbone n'a plus d'octet. De plus, la distance de liaison mesurée dans le monoxyde de carbone est plus courte que ce que l'on peut attendre d'une double liaison. Pour la troisième structure, la charge formelle est en accord avec l'électronégativité de chaque atome, mais l'atome de carbone n'a que quatre électrons autour de lui et est donc absolument instable.
Intoxication
L'excès de monoxyde de carbone provoque un empoisonnement, une intoxication. Si vous respirez, même en quantité modérée, le monoxyde de carbone peut causer la mort par empoisonnement en quelques minutes car il remplace l'oxygène dans l'hémoglobine du sang. Il a une affinité pour le groupe hème 220 fois plus grande que l'oxygène.
La carboxyhémoglobine, le produit formé, ne peut pas transporter l'oxygène; de plus, la présence de ce composé interfère avec la dissociation de l'oxygène de l'oxyhémoglobine restante, gênant ainsi le transfert d'oxygène vers les tissus.
Une fois qu'une assez grande quantité de monoxyde de carbone est respirée (en prenant 75 % de l'hémoglobine avec du monoxyde de carbone), la seule façon de survivre est de respirer de l'oxygène pur. Chaque année, un grand nombre de personnes perdent accidentellement la vie à cause d'un empoisonnement avec ce gaz. Les femmes enceintes et leurs foetus, les jeunes enfants, les personnes âgées et celles qui souffrent d'anémie, de problèmes cardiaques ou respiratoires peuvent être beaucoup plus sensibles au monoxyde de carbone.
On estime que les adultes normaux non fumeurs ont des taux de carboxyhémoglobine inférieurs à 1 % de saturation; c'est-à-dire que 1 % de l'hémoglobine est lié au monoxyde de carbone. Ce chiffre a été attribué à la formation endogène de CO. Les fumeurs peuvent avoir une saturation de 5 à 10 %, selon l'intensité de leur tabagisme. Une personne qui respire de l'air avec 0,1 % de CO (1 000 ppm) a un taux de carboxyhémoglobine de 50 %.
Le traitement consiste à retirer la personne de la source d'exposition et à prendre des mesures pour assurer sa respiration. L'oxygène fonctionne comme un antagoniste de CO spécifique et pour cette raison, il est administré en tant que traitement. La durée de vie moyenne du CO dans le sang est de 320 minutes; avec de l'oxygène pur, il est réduit à 80 minutes et avec de l'oxygène hyperbare (2 ou 3 atmosphères) il peut diminuer à 20 minutes.
Prévention
Le monoxyde de carbone est notamment présent dans les gaz d'échappement des voitures et dans la fumée du tabac (les fumeurs ont un pourcentage mesurable de monoxyde de carbone dans leur sang). Parce que le charbon était un combustible important pour chauffer les maisons sous forme de charbon, ce qui entraînait parfois des accidents dans les cheminées et les poêles mal entretenus, le monoxyde de carbone est également connu sous le nom de vapeur de charbon. La présence de monoxyde de carbone dans la combustion du gaz naturel dans les poêles et les geysers dans les zones mal ventilées est notoire. Une intoxication au monoxyde de carbone peut survenir.
Le monoxyde de carbone est naturellement présent dans l'environnement suite aux éruptions volcaniques (avec le dioxyde de soufre, le dioxyde de carbone, l'hydrogène sulfuré et le sulfure de carbone), au dégazage des marécages (avec le méthane) et aux feux de forêt. Le gaz est également libéré dans de nombreuses activités industrielles (raffineries de pétrole et incinérateurs).
Histoire
Le monoxyde de carbone a été découvert par le zinc par le chimiste français De Lassone en 1776 en chauffant de l'oxyde de zinc avec du coke. Il croyait à tort que c'était de l'hydrogène parce qu'il générait une flamme bleue. Plus tard, en 1 800, le chimiste anglais William Cruikshank prouva que ledit composé contenait du carbone et de l'oxygène.
Les propriétés toxiques du CO ont été étudiées en profondeur par le physicien français Claude Bernard en 1846. L'empoisonnement des chiens avec le gaz détecté montrait que leur sang est devenu plus rouge et brillant dans tous les tissus.
Pendant la Seconde Guerre mondiale, le monoxyde de carbone était utilisé dans les moteurs des véhicules car l'essence était rare. Du charbon minéral ou végétal a été introduit et le monoxyde de carbone généré par gazéification a alimenté le carburateur. Le CO a également été utilisé comme méthode d'extermination (chambres à gaz) pendant l'Holocauste dans les camps de concentration.
Chimie de coordination
Le monoxyde de carbone peut avoir de fortes interactions avec un grand nombre de métaux et d'ions métalliques, en particulier des métaux de transition. Les composés résultants sont appelés complexes carbonyle (sulfure de carbonyle = oxysulfure de carbone par exemple). La symétrie (forme) de HOMO et LUMO en est largement responsable. L'orbitale σ (2p) remplie (le HOMO) a un grand coefficient (une grande contribution atomique) du côté de l'atome de carbone et peut faire don de la densité électronique à un atome de métal, par exemple en entrant une liaison σ avec le dx2-y2 -orbitales. L'orbitale π x (2p) vide (le LUMO) peut accepter la densité électronique de l'ion métallique via une interaction π, pourvu qu'il ait rempli des orbitales de symétrie appropriée (comme l'orbitale dxz).
Cette forme d'interaction mutuelle est également appelée liaison pi-back (liaison arrière via l'orbitale π-moléculaire). Le monoxyde de carbone est donc un ligand pi-accepteur et forme facilement des complexes à faible spin (il génère un fort champ de ligand). La liaison pi-back explique la stabilité d'un certain nombre de complexes carbonyle tels que le chrome hexacarbonyle, le molybdène hexacarbonyle, le tungstène hexacarbonyle, le fer pentacarbonyle et le nickel tétracarbonyle. Ce dernier composé est formé même lorsque le nickel est simplement exposé au monoxyde de carbone.
Synonymes, antonymes
Voir tous les synonymes pour "monoxyde de carbone".2 synonymes (sens proche) de "monoxyde de carbone" :
- gaz toxique
- oxyde de carbone
1 antonyme (sens contraire) :
Les mots ou les expressions apparentés à MONOXYDE DE CARBONE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
L'expression MONOXYDE DE CARBONE est dans la page 5 des mots en M du lexique du dictionnaire.
Mots en M à proximité
monotypique monovalent monoxène monoxyde monoxyde d'azote monoxyde de carbonemonozygote montagne montée des eaux mop moraine
En rapport avec "monoxyde de carbone"

Le carbone, du groupe des non-métaux, est unique dans ses propriétés chimiques parce qu'il forme un nombre de composants supérieurs au nombre résultant...
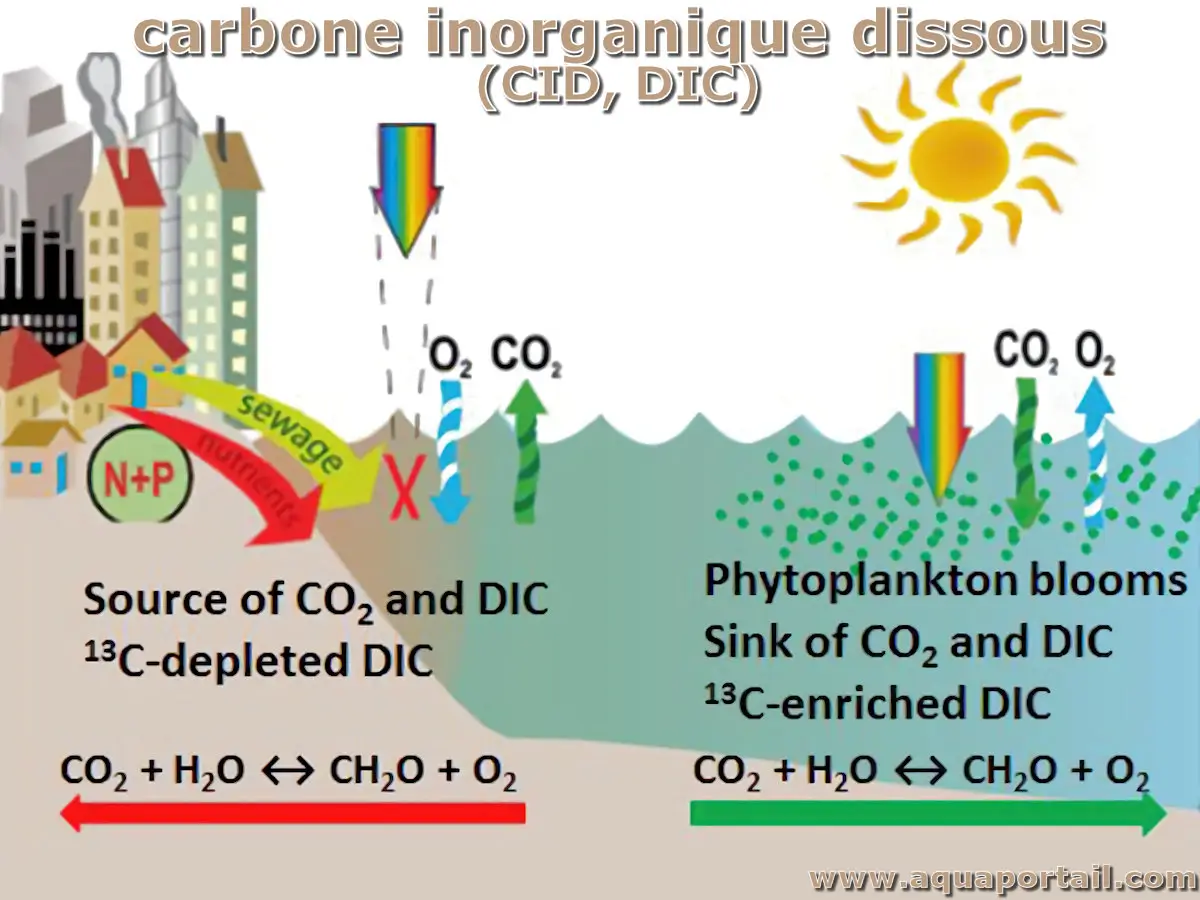
Le carbone inorganique dissous (CID) est l'ensemble du dioxyde de carbone (CO₂), des ions bicarbonate (HCO₃⁻) et des ions carbonate (CO₃²⁻) présents dans...
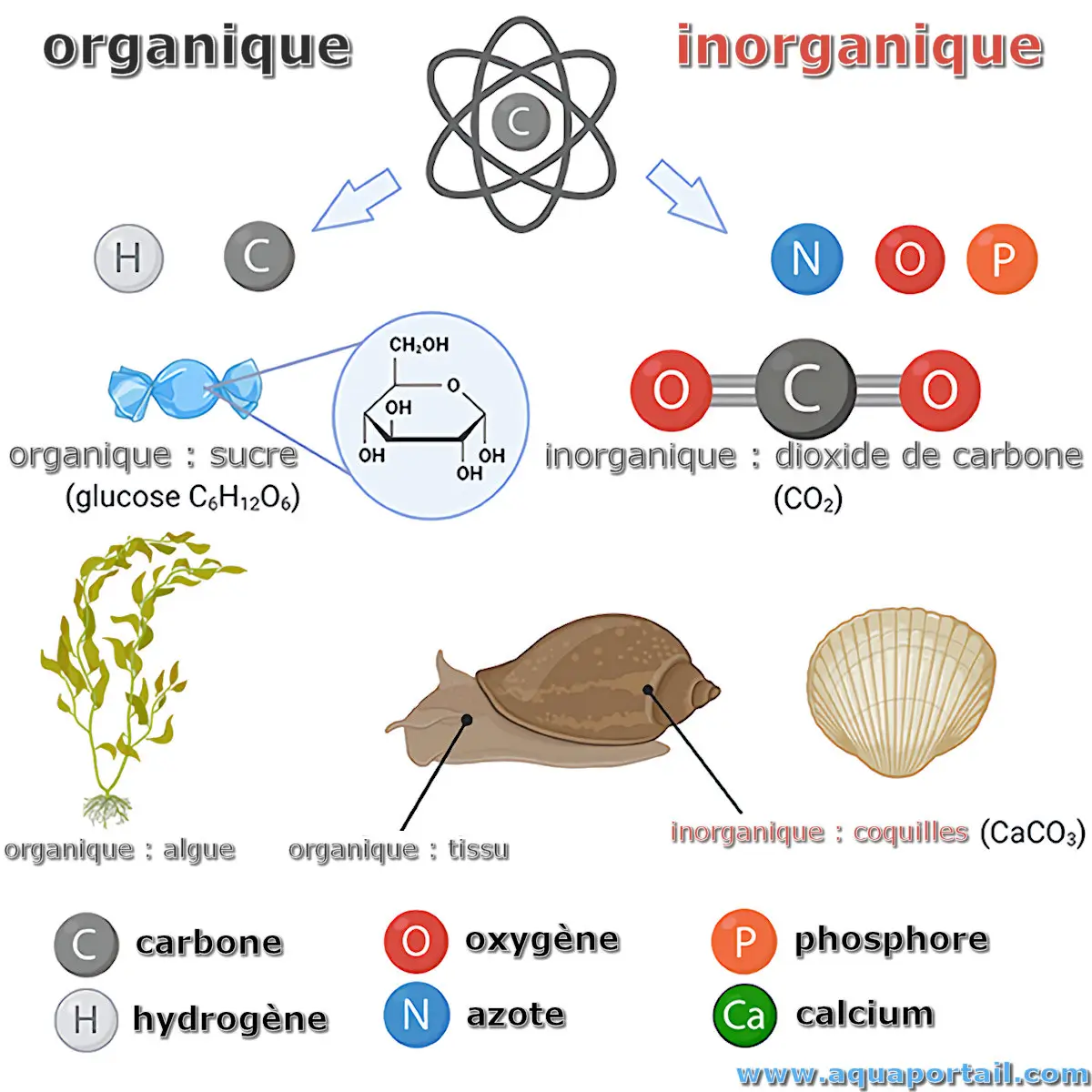
Le carbone organique est naturellement produit par tous les organismes vivants, pouvant être dissous (COD) ou particulaire (COP).
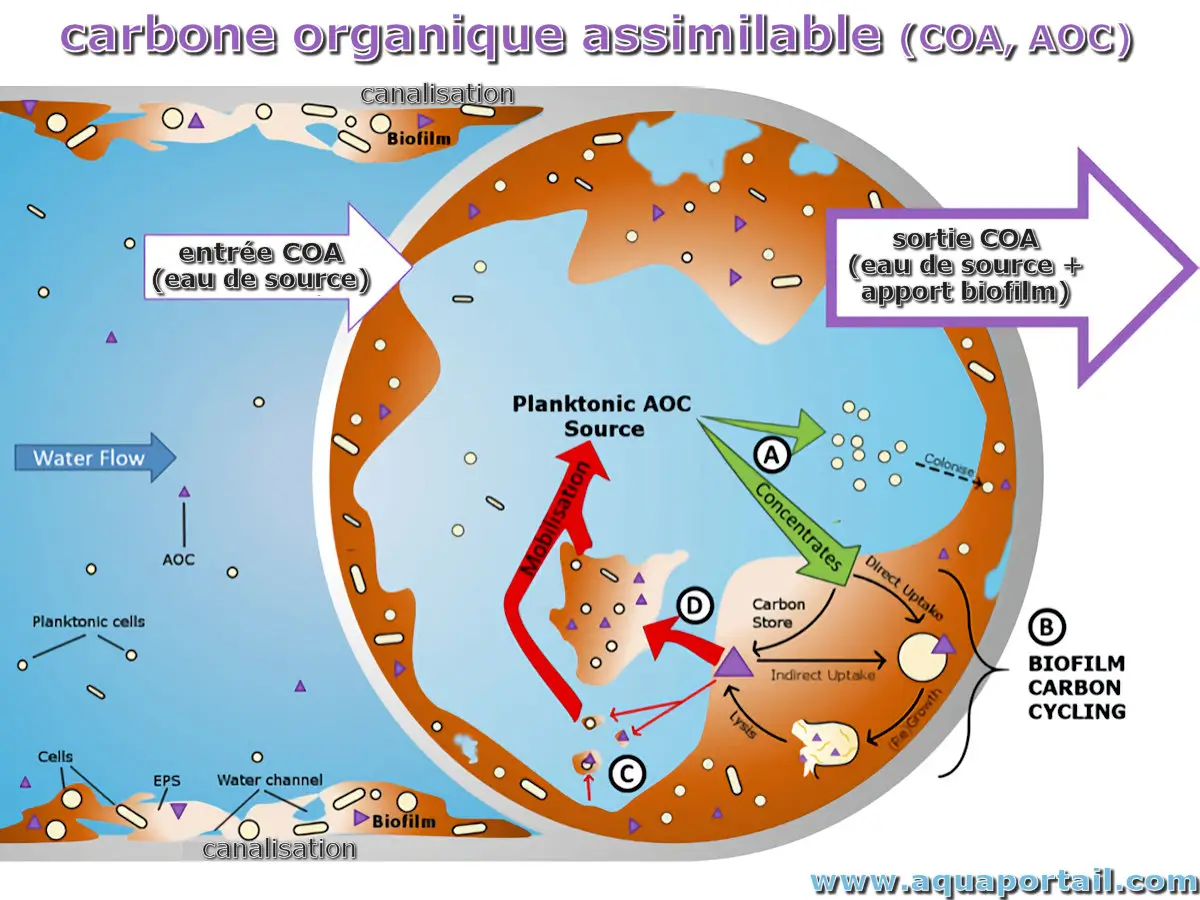
Le carbone organique assimilable (COA) est la partie du carbone organique total facilement assimilable par les micro-organismes hétérotrophes, ce qui favorise...
