Procollagène
Définition
Les propeptides procollagènes sont des produits de cellules qui synthétisent les collagènes fibrillaires et sont donc, dans le cancer, liés à la réaction des tissus environnants à la malignité. Les propeptides du procollagène, le propeptide carboxy-terminal du procollagène de type I (PICP) et le propeptide aminoterminal du procollagène de type I (PINP), sont libérés dans la circulation au cours de la conversion extracellulaire du procollagène en collagène.
Origines du procollagène :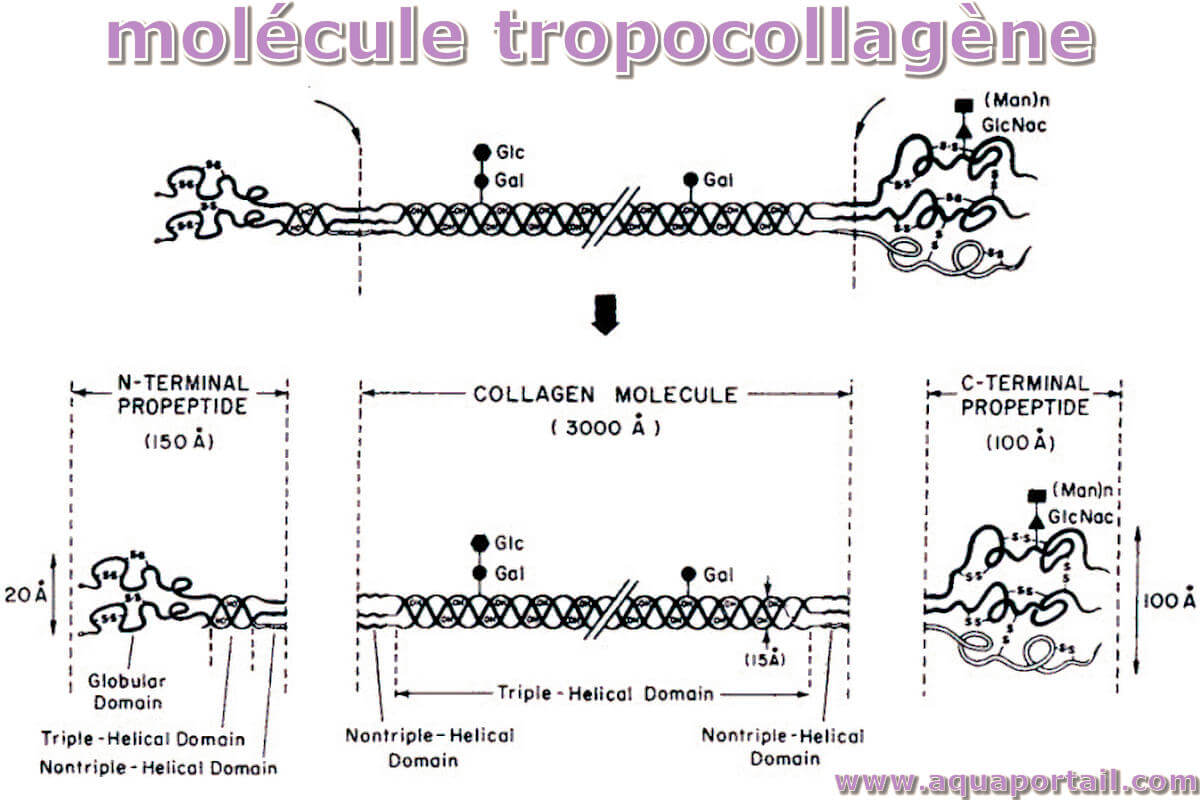
Le clivage extracellulaire des propeptides du collagène de type I, illustre les origines des marqueurs de la formation osseuse, le propeptide carboxy-terminal du procollagène de type I (PICP) et le propeptide aminoterminal du procollagène de type I (PINP).
Explications
Le collagène de type I est un trimère comprenant deux chaînes polypeptidiques α1 (I) identiques et une chaîne polypeptidique α2 (I) et est la principale protéine de la matrice osseuse (90 %). Il est synthétisé par les ostéoblastes en tant que précurseur, le procollagène, et sécrété dans l'espace extracellulaire, où il subit une série de modifications post-traductionnelles dont le clivage des propeptides par des protéases spécifiques.
Les propeptides sont libérés dans la circulation et les molécules de collagène nouvellement formées s'assemblent sous forme de fibrilles. Le PICP est un polypeptide globulaire d'un poids moléculaire de 100 kDa, qui contient à la fois des ponts disulfure intrachaîne et interchaîne. Le PINP est un polypeptide plus petit avec un poids moléculaire de 35 kDa, avec des ponts disulfure intrachaîne mais pas de pont disulfure interchaîne. C'est principalement un peptide globulaire mais contient une petite quantité d'hélice.
Transformation du procollagène en collagène
Le procollagène est finalement modifié en collagène dans l'appareil de Golgi. Après assemblage en triple hélice, le procollagène est transporté du RER vers le compartiment de Golgi, où il est conditionné dans des vésicules de sécrétion, puis exporté vers l'espace extracellulaire par exocytose. Les extensions non hélicoïdales du procollagène sont éliminées dans l'espace extracellulaire par des protéinases spécifiques du procollagène N- et C-terminal.
Les molécules de collagène (anciennement appelées tropocollagène) s'auto-assemblent ensuite en fibrilles de collagène insolubles, qui sont ensuite stabilisées par la formation de réticulations intermoléculaires dérivées d'aldéhydes. La lysyl-oxydase (LOX, à ne pas confondre avec la lysyl-hydroxylase impliquée dans la formation de l'hydroxylysine) élimine par oxydation (désamine) le groupe ε-amino de certains résidus de lysine et d'hydroxylysine, produisant des dérivés aldéhyde réactifs appelés allysine et hydroxyallysine. Les groupes aldéhyde forment maintenant des produits de condensation aldol avec les groupes aldéhyde voisins, générant des réticulations à la fois à l'intérieur et entre les molécules à triple hélice. Ils peuvent également réagir avec les groupes amino des résidus lysine et hydroxylysine non oxydés pour former des réticulations à base de Schiff (imine).
Les produits initiaux peuvent se réarranger ou être déshydratés ou réduits pour former des réticulations stables, telles que la lysinonorleucine. Des études avec l'β-aminopropionitrile, qui inhibe l'enzyme lysyl-oxydase, établissent que la formation de réticulation du collagène est un déterminant majeur des propriétés mécaniques et de la résistance des tissus. L'inhibition de la lysyl-oxydase peut entraîner un lathyrisme, une maladie induite par l'alimentation caractérisée par une déformation de la colonne vertébrale, une luxation des articulations, une déminéralisation des os, des anévrismes aortiques et des hémorragies articulaires.
Le lathyrisme peut être causé par l'ingestion chronique du pois de senteur Lathyrus odoratus, dont les graines contiennent du β-aminopropionitrile, un inhibiteur irréversible de la lysyl-oxydase.
Rôle dans l'ostéogenèse imparfaite
Dans une ostéogenèse imparfaite à masse osseuse élevée, il y a clivage du propeptide procollagène C. Des mutations autosomiques dominantes dans le site de clivage du propeptide C du procollagène ou des défauts récessifs de l'enzyme responsable de son clivage provoquent une fragilité osseuse avec des scores z de densité osseuse d'absorptiométrie aux rayons X à double énergie normaux ou élevés.
Les individus porteurs de mutations dominantes ont une stature normale, une sclérotique et des dents blanches et une ostéogenèse imparfaite légère à modérée. Des mutations nulles dans BMP1 conduisent à un phénotype squelettique plus sévère avec une petite taille, une scoliose et une déformation osseuse, car BMP1 a d'autres substrats en plus du collagène de type I.
Procollagène C-Protéinase
L'activité procollagène C-endopeptidase de mTll-1 est stimulée par le procollagène C-protéinase activateur-1 (PCPE-1). L'amélioration de l'activité enzymatique est médiée par la liaison de PCPE-1 au pro-peptide C du procollagène (substrat) et à mTll-1, apparemment, via ses domaines C-terminaux.
L'activité PCP/BMP-1 est inhibée par des chélateurs non spécifiques tels que l'EDTA, l'EGTA et la 1,10-phénanthroline, les acides aminés basiques (par exemple Arg, Lys; 5–10 mM), des concentrations élevées (0,2–0,5 M) de NaCl et tampons Tris-HCl, DTT, N-éthylmaléimide (~20 mM), concanavaline A et α2-macroglobuline.
Procollagène C-endopeptidase
Le nom procollagène C-endopeptidase reflète le rôle que cette enzyme joue dans le traitement du procollagène, l'élimination des propeptides carboxyles des procollagènes. Cette activité a été notée pour la première fois dans des cultures de fibroblastes humains et murins, et dans la clavaire et le tendon d'embryon de poulet. Les premiers noms de l'enzyme comprenaient la procollagène C-peptidase, la carboxyl-procollagène peptidase et la procollagène peptidase carboxy-terminale; le nom procollagène C-protéinase (PCP) est utilisé dans ce chapitre. Bien que des protéinases acides de type cathepsine aient été impliquées dans le traitement C-terminal du procollagène, des PCP spécifiques agissant à pH neutre ont finalement été identifiés.
Synonymes, antonymes
Voir tous les synonymes pour "procollagène".1 synonyme (sens proche) de "procollagène" :
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à PROCOLLAGÈNE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot PROCOLLAGENE est dans la page 8 des mots en P du lexique du dictionnaire.
Mots en P à proximité
processus articulaire processus biologique prochloron prochordé proclive procollagèneprocombant procréation proctoptérygie procuticule procyte
En rapport avec "procollagène"

Le collagène est un complexe protéique constitué de trois chaînes de collagène assemblées en une triple hélice lévogyre.

L'ostéogenèse est une genèse de tissu osseux aboutissant à la formation d'os par ossification.
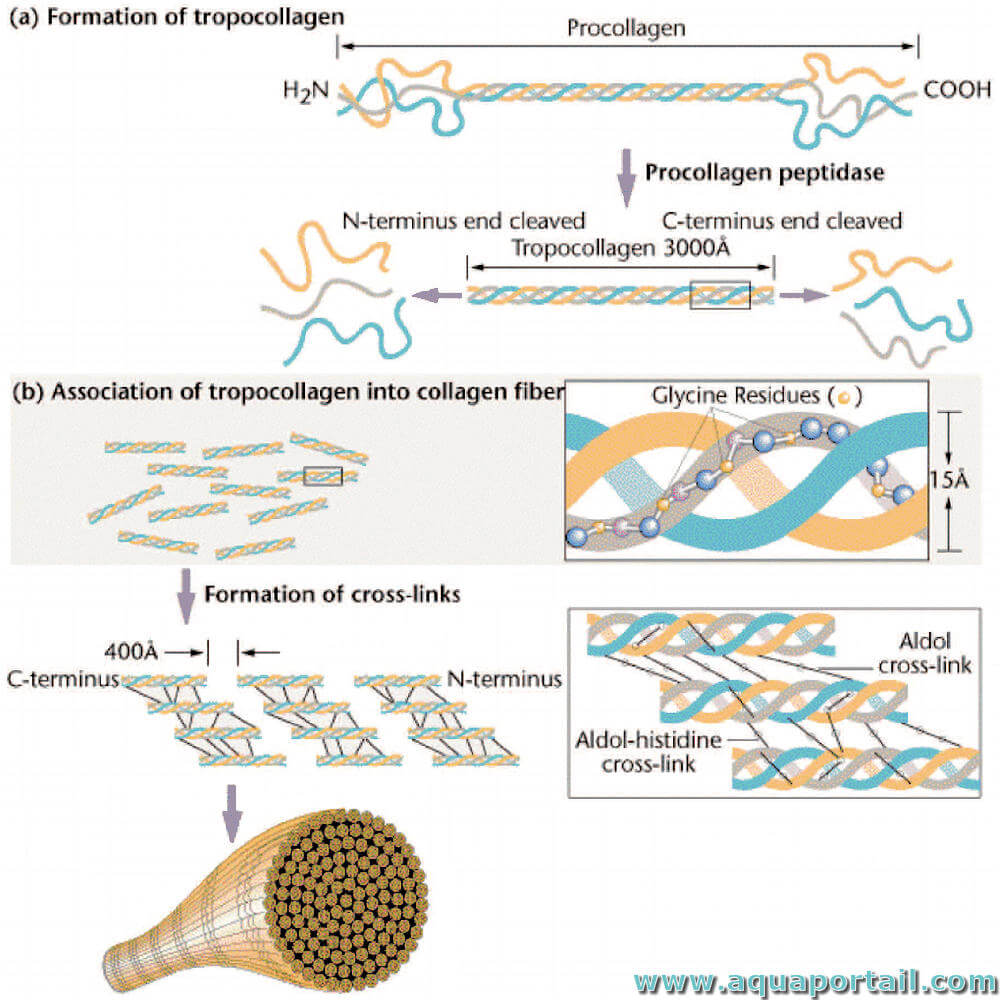
Le tropocollagène est l'unité structurelle d'une fibre de collagène. Cette molécule de collagène est composée de trois brins polypeptidiques (peptides...
