Une maladie auto-immune
Une maladie auto-immune précise que les lésions des organes d'un individu ont été causées par son propre système immunitaire. Cette maladie s'applique à tout le règne animal. Cette auto-immunité attaque les cellules de l'organisme. Dans ce cas, le système immunitaire devient l'agresseur et attaque et détruit les organes sains et les tissus du corps eux-mêmes, au lieu de les protéger. Il existe une réponse immunitaire exagérée contre les substances et les tissus normalement présents dans l'organisme.
L'hémoglobine d'une anémie hémolytique auto-immune :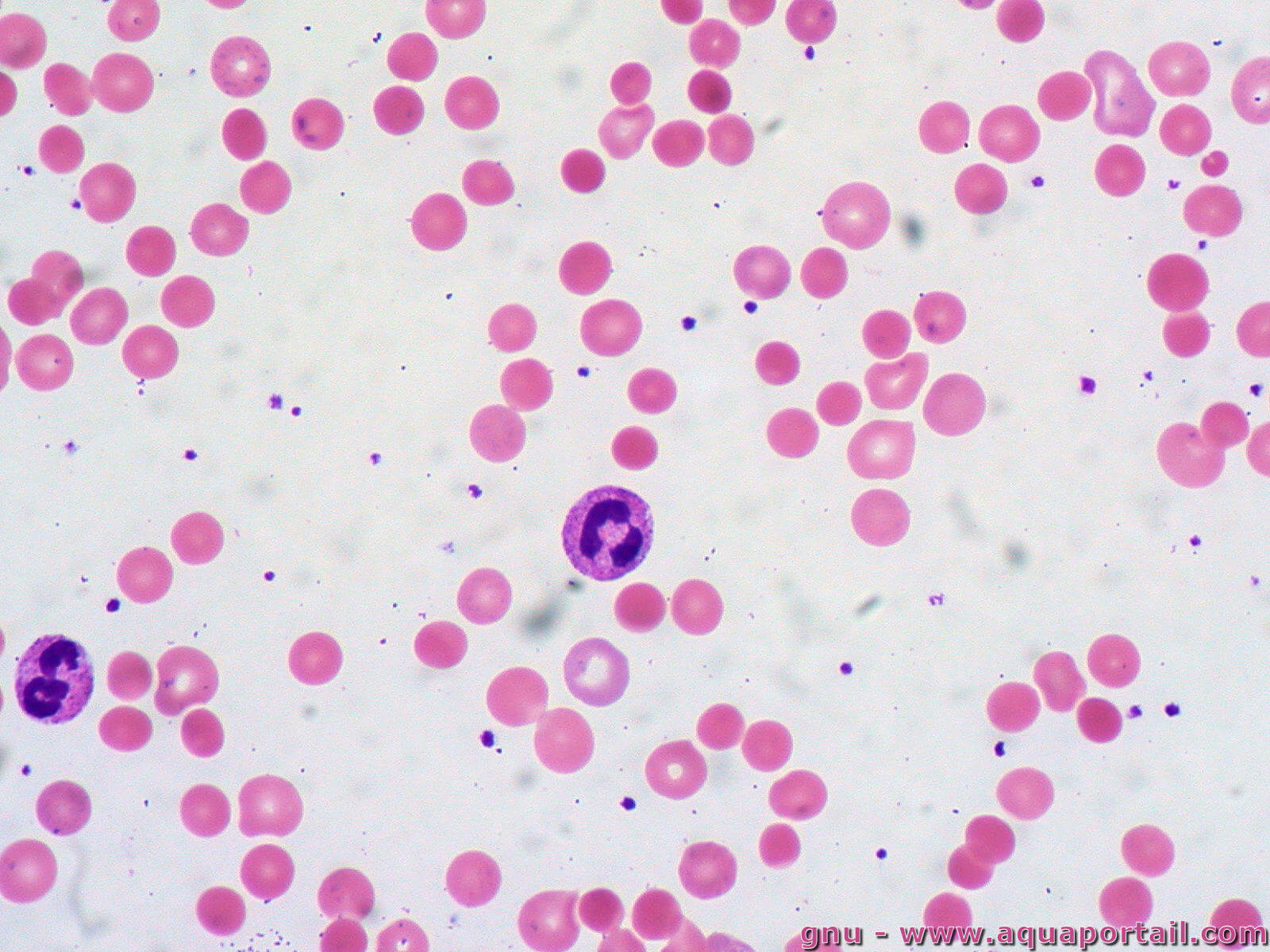
La maladie auto-immune identifiée dans les cellules d'hémoglobine par un test de Colombs direct est une anémie hémolytique.
Généralités
Plus de 80 maladies auto-immunes ont été identifiées. Les plus fréquentes sont la maladie coeliaque, le diabète de type 1, la polyarthrite rhumatoïde, le lupus érythémateux disséminé et la sclérose en plaques.
La maladie auto-immune est un terme générique en médecine pour les maladies qui sont basées sur une tolérance perturbée du système immunitaire au corps. Au sens large, les réactions immunitaires contre le microbiome, c'est-à-dire les attaques de micro-organismes appartenant au corps, sont également attribuées à des maladies auto-immunes. Les réactions auto-immunes sont souvent similaires aux réponses immunitaires aux agents pathogènes, et les complexes immuns ou les récepteurs peuvent induire des anticorps activants/bloquants de la maladie symptomatique.
Dans les pays occidentaux, environ 5 % de la population est touchée par une maladie auto-immune, les plus courantes étant le psoriasis, la polyarthrite rhumatoïde et la maladie thyroïdienne auto-immune (maladie de Graves et thyroïdite de Hashimoto). De nombreuses maladies auto-immunes sont plus courantes ou classiques chez les femmes que chez les hommes. Les maladies auto-immunes sont jusqu'ici mal comprises et ne peuvent être traitées de manière causale; Ils restent souvent toute la vie et peuvent être traités comme anti-inflammatoires ou immunosuppresseurs pour soulager l'inconfort ou pour arrêter la destruction des organes touchés.
Considérations de base
Les cellules immunitaires possèdent des armes puissantes qui peuvent tuer presque toutes les cellules. Le plus grand défi consiste souvent à détecter des agents pathogènes sans attaquer simultanément les structures propres du corps, les micro-organismes bénéfiques (flore commensale) ou les substances étrangères inoffensives sur la peau et les muqueuses. Les cellules immunitaires testent leur environnement au moyen de récepteurs moléculaires : une liaison forte à une structure (un antigène) active la cellule et initie des mesures défensives, en particulier si d'autres cellules ont reconnu un agent pathogène, et les informe via des médiateurs inflammatoires. Déjà, la distinction entre cellules endogènes et étrangères est un problème à ne pas sous-estimer, car les agents pathogènes sont soumis à une évolution très rapide, de sorte que des organismes plus complexes sont à peine capables de co-évoluer à travers un récepteur conventionnel adapté à la détection de tous les agents pathogènes, en particulier dans l'espace génomique (chez l'homme environ 23 000 gènes) est limitée. Cependant, il existe certains modèles moléculaires conservés associés aux agents pathogènes (PAMP) qui sont exprimés par de nombreux agents pathogènes et également reconnus par les cellules immunitaires via les récepteurs de reconnaissance des modèles (PRP); Cependant, des récepteurs plus efficaces sont nécessaires pour contrôler efficacement de nombreux agents pathogènes.
Par conséquent, en plus de l'inné, les humains ont également une immunité adaptative sous forme de cellules B et T. Chacune de ces cellules exprime exactement un récepteur résultant d'une recombinaison aléatoire et d'une hypermutation de leur ADN. Ainsi, tout d'abord, une grande variété de cellules immunitaires est créée, qui est dirigée contre "tout ce qui est possible". Les cellules déjà activées au cours de la maturation sont susceptibles de réagir aux structures endogènes et sont donc triées; c'est ainsi que se forme la tolérance centrale. Cependant, il n'ya aucun doute que les récepteurs ne peuvent que se lier ou ne pas se lier; il s'agit plutôt de la probabilité et de la force de la liaison, toutes les gradations étant possibles. Si toutes les cellules étaient retirées et que les structures propres du corps ne se liaient que faiblement, certains agents pathogènes ne pourraient plus être reconnus; entre tolérance de soi et force de défense, un compromis doit donc être trouvé. L'existence de certaines cellules et d'anticorps autoréactifs est normale et certaines cellules T autoréactives (appelées cellules T régulatrices) sont même reprogrammées pour supprimer les réponses immunitaires dans leur environnement lorsqu'elles sont activées.
La tolérance centrale est complétée par des mécanismes de tolérance périphérique. À ce stade, la tolérance à la flore commensale et aux matières étrangères inoffensives est également formée. En divisant une seule cellule immunitaire, on peut produire un grand clone de cellules du même récepteur, ce qui s'ajoute à la liaison à un antigène mais consiste en une co-stimulation de médiateurs inflammatoires (sécrétée par des cellules à immunité innée après détection de PAMP), nécessaire dans le cas des cellules B (plasmocytes ultérieurs produisant des anticorps) en plus de l'interaction directe avec les lymphocytes T activés. Les cellules B et T reconnaissant des structures inoffensives ne sont généralement pas stimulées par la costimulation et, en raison du nombre limité de cellules immunitaires, sont déplacées par la division des populations de cellules. La liaison sans costimulation peut également induire la mort ou au moins une "paralysie" de la cellule ou produire des cellules T régulatrices. Enfin, il existe des zones privilégiées pour le système immunitaire (cerveau, oeil, testicules) où il existe des obstacles particulièrement importants à l'initiation de l'inflammation, de sorte que les cellules B ou T ne peuvent normalement pas y être activées. Certaines cellules autoréactives ne sont pas activées car leurs structures cibles ne sont normalement pas accessibles à une concentration suffisante, peut-être parce qu'elles sont intracellulaires; La tolérance contribue également à l'élimination rapide des cellules mortes par les phagocytes (macrophages).
Aucun de ces mécanismes n'est parfait, mais tous ensemble garantissent que les réponses immunitaires se limitent presque toujours à des intrus réellement dommageables. Cependant, une seule cellule autoréactive qui surmonte tous ces obstacles peut initier une réaction auto-immune dont l'évolution inflammatoire peut précipiter des barrières à la tolérance périphérique (libération de médiateurs inflammatoires, leurre de cellules immunitaires, suppression des privilèges immunitaires, disponibilité et présentation d'antigènes intracellulaires par mort cellulaire massive...). En conséquence, d'autres cellules autoréactives peuvent être activées, qui attaquent le même antigène via de nouvelles sous-structures (propagation d'épitope). Il reste difficile de comprendre pourquoi de nombreuses maladies auto-immunes deviennent cahoteuses, au lieu de s'auto-renforcer, certaines ne se manifestent qu'une seule fois ou guérissent spontanément après des années.
Développement
Le développement des maladies auto-immunes peut être décrit au mieux avec un modèle de facteur de risque ("malchance" et "mauvais gènes") : Facteurs génétiques d'une part et facteurs environnementaux et autres (stress élevé, infections, grossesse... d'autre part, influencer le risque de maladie sans qu'un certain maquillage génétique ou un environnement ne soit capable de causer ou de prévenir en toute sécurité une maladie auto-immune.
Ce modèle de risque n'est probablement pas la seule expression de nos connaissances incomplètes; le développement d'une maladie auto-immune nécessitera en effet probablement beaucoup de poix. Ceci est brièvement illustré par l'exemple d'un lymphocyte B autoréactif, activé par un lymphocyte T autoréactif pour un plasmocyte producteur d'auto-anticorps : Premièrement, deux cellules doivent échapper à la tolérance centrale, qui se trouve être identique reconnaître le propre antigène du corps. Les deux cellules doivent maintenant coïncider avec cette structure au même moment et recevoir également des signaux de co-stimulation. Après tout, les deux cellules doivent se rencontrer par hasard dans un ganglion lymphatique pour pouvoir interagir l'une avec l'autre. On peut imaginer que tout cela arrive à une personne au cours de la vie, alors que l'autre ne le fait pas, même s'il a les mêmes conditions.
Étiologie
En général, il est admis que l'interaction entre facteurs environnementaux et gènes de susceptibilité spécifiques est responsable de l'apparition de maladies auto-immunes. Moins de 10 % des personnes ayant une susceptibilité génétique plus grande développent la maladie, ce qui suggère un puissant déclencheur environnemental, qui affecte également les progrès et le pronostic de la maladie. La théorie actuelle est que les antigènes absorbés par l'intestin peuvent être impliqués.
Prédisposition génétique
Des études d'association pangénomiques ont montré que, pour de nombreuses maladies auto-immunes, elles surviennent plus fréquemment en présence de certaines variantes du gène. Les gènes affectés codent régulièrement pour les récepteurs des médiateurs inflammatoires et des protéines du traitement du signal intracellulaire, mais plus particulièrement pour les molécules du CMH dans les allèles caractéristiques de la maladie : contrairement aux cellules B, les cellules T ne reconnaissent pas directement les structures des envahisseurs potentiels, mais uniquement les peptides (courtes séquences d'acides aminés).) présentés par d'autres cellules sur certaines protéines membranaires, à savoir les molécules du CMH. Toutes les cellules du corps dégradent en permanence certaines de leurs protéines pour en présenter des fragments sur les molécules du CMH de classe 1; Cela garantit que même les agents pathogènes intracellulaires ne peuvent pas se cacher du système immunitaire. Les cellules présentatrices d'antigène professionnelles (macrophages, cellules dendritiques et cellules B) ingèrent (phagocytent) les cellules suspectes et les débris cellulaires et présentent les peptides digestifs au travers de molécules de classe 2 du CMH.
Les molécules de CMH sont largement présentes dans la population, car la formation de la poche de liaison déterminée génétiquement ne permet que la présentation de peptides appropriés. L'ensemble des molécules du CMH qu'un humain possède détermine ce que les lymphocytes T peuvent voir et donc, dans le cas de maladies auto-immunes telles que les maladies infectieuses, contre lequel des réactions immunitaires sont particulièrement faciles à déclencher.
Facteurs environnementaux
L'infection par des agents pathogènes ressemblant à des structures endogènes est un facteur environnemental facile à comprendre. De tels agents pathogènes ne sont pas rares, car ils exercent une pression sélective pour se conformer à l'organisme hôte afin d'être moins facilement reconnus comme étrangers; Cette stratégie s'appelle également imitation moléculaire. Dans la réaction immunitaire contre l'agent pathogène, des cellules immunitaires autoréactives sont activées, dont la prolifération est extrêmement utile, mais rend plus probables des réactions auto-immunes - même des années plus tard, à la formation de cellules mémoire. De plus, les anticorps formés en grande quantité au cours de l'infection aiguë peuvent avoir une réactivité croisée, c'est -à- dire qu'ils se lient aux cellules de l'organisme avec une affinité suffisante pour être détruits par les anticorps. Un exemple est le rhumatisme articulaire aigu, dans lequel, après une infection à streptocoques β-hémolytiques par des anticorps à réactivité croisée, le coeur est attaqué.
Certaines maladies auto-immunes montrent une accumulation évidente dans les pays industrialisés. Une hypothèse possible est fournie par l'hypothèse d'hygiène, qui traite des interactions entre les bactéries et notre système immunitaire. Une exposition insuffisante aux bactéries dans l'environnement pourrait favoriser le développement de maladies immunitaires. Une autre facette de cette thèse concerne la composition des bactéries intestinales et leurs effets sur le système immunitaire. En principe, les femmes sont plus souvent atteintes de maladies auto-immunes, pour lesquelles les hormones féminines (oestrogènes) sont généralement citées. Une étude chez la souris suggère cependant que la composition différente des bactéries intestinales des femmes et des hommes pourrait être une cause supplémentaire possible.
Mécanismes de dommages
Les réactions auto-immunes impliquent l'interaction de différents types de cellules (cellules T, cellules B, phagocytes, granulocytes) et de facteurs solubles (anticorps, système du complément) de l'immunité acquise et innée; leur complexité ne diffère pas des réponses immunitaires aux agents pathogènes. Les mécanismes d'endommagement sont également souvent les mêmes, par exemple la cytotoxicité dépendante des anticorps (par l'activation du complément ou des cellules tueuses naturelles) ou la cytotoxicité des lymphocytes T.
analogues à l'allergie, les maladies auto-immunes peuvent être grossièrement divisées en trois groupes en fonction de leur pathogenèse :
- Type II : dommages aux cellules induits par des auto-anticorps qui se lient à leur surface ou à leur matrice extracellulaire. Exemple : anémies hémolytiques auto-immunes.
- Type III : Les anticorps agglutinent les antigènes solubles dans le sang. Les complexes immuns qui en résultent se déposent dans de petits vaisseaux sanguins et y activent le système du complément. Exemple : vascularite à IgA (anciennement purpura de Schönlein-Henoch).
- Type IV : Dommages directs causés par les cellules T autoréactives. Exemple : polyarthrite rhumatoïde.
Les anticorps qui interfèrent avec la communication intercellulaire en se liant à des récepteurs et en les activant ou les bloquant sont une caractéristique particulière. Par exemple, dans la maladie de Basedow, une production excessive d'hormones thyroïdiennes intervient parce que des auto-anticorps dirigés contre le récepteur de la TSH l'activent par leur liaison. Les anticorps anti-récepteurs nicotiniques de l'acétylcholine, par contre, provoquent une faiblesse musculaire dans la myasthénie grave en bloquant la communication muscle-nerf. Le facteur rhumatoïde fait référence aux anticorps dirigés contre la partie constante des anticorps IgG. Les anticorps cytoplasmiques anti-neutrophiles (ANCA) sont des anticorps dirigés contre les granulocytes neutrophiles, qui peuvent également activer ces cellules immunitaires.
Certaines maladies auto-immunes sont étonnamment courantes, ce qui s'explique par des mécanismes pathologiques similaires. Pour certaines maladies auto-immunes, les anticorps semblent revêtir une importance particulière pour les autres sous-groupes de cellules T; Ces résultats fournissent des approches pour des thérapies plus spécifiques. Les auto - anticorps sont beaucoup plus faciles à détecter que les cellules autoréactives; Si un auto-anticorps s'avère apte à diagnostiquer une maladie auto-immune particulière, cela n'implique pas encore que cet anticorps déclenche la maladie, contribue à son évolution ou constitue un mécanisme important de dommage.
Diagnostic d'anticorps
Le facteur décisif est le niveau des titres sérologiques d'auto-anticorps existants en tant que critère de diagnostic d'une maladie auto-immune, car les auto-anticorps sont généralement physiologiques (par exemple, ANA, anticorps anti-ADNd et anticorps anti-phospholipides). Dépasser un titre donné est considéré comme pathologique. Certains auto-anticorps ne sont pas physiologiques et sont considérés en premier lieu comme pathologiques (par exemple, ANCA et anticorps endomysiaux). De plus, l'augmentation des titres d'auto-anticorps existants ou existants n'est pas nécessairement nécessaire pour le diagnostic de la maladie auto-immune, car une maladie auto-immune est présentée sur la base de critères sérologiques et cliniques. Seuls les titres d'auto-anticorps pathologiques élevés ou existants ne sont pas suffisants pour établir un diagnostic, car ils sont basés sur un score (permettant d'atteindre un certain score).
Thérapie
Selon le type d'organe, les maladies auto-immunes sont traitées par les spécialistes respectifs : internistes, rhumatologues, dermatologues, neurologues, endocrinologues ou médecins nucléaires. Le traitement est symptomatique ou implique une pharmacothérapie avec des médicaments anti-inflammatoires, spécialement immunosuppresseurs, qui inhibent généralement les réponses immunitaires (y compris contre les agents pathogènes). Parmi les agents immunosuppresseurs, la cortisone est l'hormone endogène la plus tolérable dans le corps, mais elle supporte à long terme le risque de syndrome de Cushing. Des médicaments plus modernes, qui interviennent spécifiquement dans la communication entre les cellules immunitaires et sont donc mieux adaptés à une maladie spécifique, sont appelés cliniquement biologiques. Ce sont des protéines génétiquement modifiées (souvent des anticorps ou des dérivés d'elles) qui piègent des médiateurs inflammatoires ou bloquent les récepteurs des cellules immunitaires.
La guérison n'est possible que par une destruction radicale du système immunitaire (suivie d'une greffe de cellules souches); Cependant, cette procédure est si dangereuse qu'elle n'est utilisée que dans des cas exceptionnels. Il est possible de mettre fin à la réaction auto-immune (avec auto-immunité persistante) en retirant l'antigène de manière chirurgicale, mais cela n'est possible que pour les organes dont la fonction est inutile ou peut être remplacée. Dans le cas du diabète de type 1, la réaction auto-immune parvient elle-même à éliminer complètement l'antigène (cellules β productrices d'insuline), en ne traitant que la perte de fonction (par administration d'insuline).
Classification
Il existe des centaines de maladies auto-immunes connues, dont à elles seules environ 400 maladies sont attribuées au " Formenkreis rhumatismal ". Le spectre des organes malades est large. Il faut supposer que pratiquement tous les organes ou tissus peuvent être la cible d'une maladie auto-immune.
Il est possible de diviser ces maladies en trois groupes :
- Maladies d'organes spécifiques (syndrome local) : elles incluent des maladies dans lesquelles des organes spécifiques (structures tissulaires) sont attaqués par le système immunitaire.
- Maladies systémiques ou maladies non spécifiques à un organe : Les maladies rhumatismales inflammatoires systémiques telles que la collagénose, qui représente 5 à 10 % des maladies rhumatismales, appartiennent à ce groupe. Les auto-anticorps typiques sont les anticorps antinucléaires (ANA), dirigés contre les structures du noyau, mais aussi en partie du cytoplasme.
- Maladies intermédiaires : Ce sont des formes hybrides ou de transition. Une réponse immunitaire large est déclenchée dans ce type de maladie.
Les maladies auto-immunes systémiques (organe non spécifique) surviennent lorsque des anticorps attaquent des antigènes non spécifiques de plusieurs organes. Ainsi, il existe un groupe de maladies qui, malgré la présence de certains antigènes spécifiques de certains organes, ne présentent pas d'exclusivité pour celles-ci, telles que la polymyosite. Le meilleur exemple de ce type de maladie est le lupus érythémateux systémique, qui est plus fréquent chez les femmes en milieu de vie.
Les syndromes locaux, ou maladies d'organes spécifiques, peuvent être endocriniens (diabète sucré de type 1, maladie d'Addison, thyroïdite de Hashimoto, etc.), dermatologiques (pemphigus vulgaire) ou hématologiques (anémie hémolytique auto-immune), et impliquer un tissu particulier.
En rapport avec "maladie auto-immune"

Une maladie est toute déviation nuisible par rapport à l'état structurel ou fonctionnel normal d'un organisme, généralement associée à certains signes...

Une maladie aiguë est une maladie qui évolue rapidement, mais dure peu de temps. Une pathologie aiguë apparaît soudainement et dure un court laps de temps.

Une maladie chronique évolue lentement, sur une longue durée, et cette chronicité précise que la maladie revient fréquemment.
La maladie des algues est une maladie causée chez les poissons par un organisme ressemblant à des algues tel que Pfiesteria piscicida.
