Protochlorophyllide
Définition
La protochlorophyllide (monovinylique) est un précurseur immédiat de la chlorophylle a qui n'a pas de phytol dans la chaîne latérale de la chlorophylle. Contrairement à la chlorophylle, la protochlorophyllide est fortement fluorescente.
La protochlorophyllide oxydoréductase (POR), exclusivement dépendante de la lumière chez les Angiospermes, est responsable de la réduction successive au niveau de la double liaison C17-C18 suivie de la conversion du groupe C8-vinyle en un groupe éthyle pour finalement donner naissance au chlorophyllide a.
Mise en évidence de la protochlorophyllide en rouge dans une plante mutante :
Dans cette plante mutante, incapable de contrôler la biosynthèse de la chlorophylle, la protochlorophyllide monovinyle est visible en rouge en présence de la lumière bleue en raison la sur-accumulation de la chlorophyllide.
Explications
Les plantes mutantes accumulent la luminescence rouge si elles sont irradiées avec de la lumière bleue. Chez les Angiospermes, la dernière étape, la conversion de protochlorophyllide à la chlorophylle, est dépendante de la lumière et la photosynthèse, et ces plantes sont pâles par chlorose si elles sont cultivées dans l'obscurité. Les Gymnospermes, les algues et les bactéries photosynthétiques ont une autre enzyme, indépendante de la lumière et se développent toujours en couleur verte même si plongées dans l'obscurité.
La conversion du protochlorophyllide en chlorophylle est réalisée par l'enzyme protochlorophyllide réductase. Il y a deux protéines structurellement indépendantes avec cette activité : la lumière-dépendante et le noir-opératoire. La réductase dépendante de la lumière a besoin de lumière pour fonctionner. La version sombre est une protéine complètement différente, composée de trois sous-unités qui présentent une similitude de séquence significative avec les trois sous-unités de la nitrogénase, qui catalyse la formation d'ammoniac à partir de diazote. Cette enzyme peut être plus évolutive mais, étant similaire à la nitrogenase, est très sensible à l'oxygène libre et ne fonctionne pas si sa concentration est supérieure à environ 3 %. Par conséquent, la version alternative est dépendante de la lumière pour évoluer.
La plupart des bactéries photosynthétiques ont deux reductases : une lumière-dépendante et une lumière-indépendante. Les Angiospermes ont perdu la forme sombre-opératoire et comptent sur 3 copies légèrement différentes de la version lumière-dépendante, souvent abrégé en POR A, B et C. Les Gymnospermes ont beaucoup plus de copies du gène similaire. Chez les plantes, la POR est codée dans le noyau de la cellule et que plus tard transportée à son lieu de travail, le chloroplaste. Contrairement aux POR, dans des plantes et algues qui ont l'enzyme sombre-opératoire, elle est au moins partiellement codée dans le génome chloroplastique.
Organites et métabolites (voie dépendante de la lumière)
La NADPH-protochlorophyllide oxydoréductase (POR) est une protéine associée à la membrane plastide (pro)thylakoïde qui peut être isolée à partir de tissus étiolés, où elle comprend une partie importante des protéines membranaires totales de l'étioplaste. Dans les premiers travaux, une fraction de fragment de membrane contenant du POR était appelée holochrome de protochlorophyllide. Tel qu'isolé, le POR contient du NADPH lié et du protochlorophyllide a dans un complexe ternaire. L'exposition du complexe à la lumière qui peut être absorbée par le protochlorophyllide lié (le maximum d'absorption du rouge est à 650 nm) provoque une conversion rapide du pigment en chlorophyllide. Le POR actif solubilisé dans un détergent a une masse moléculaire d'environ 35 à 38 kD sur des gradients de glycérol ou une filtration sur gel, une valeur qui correspond au produit prédit des gènes codant pour le POR. Par conséquent, l'enzyme monomère est active. Cependant, il existe des états agrégés de l'enzyme qui peuvent être distingués du monomère par des décalages spectraux, et l'état d'agrégation pourrait être influencé par la phosphorylation des protéines. Sur la base des similitudes structurelles déduites des séquences de gènes, POR a été classé comme membre de la famille des alcools réductases secondaires.
La structure déduite de POR suggère également qu'il s'agit d'une protéine membranaire périphérique plutôt qu'intégrale. Bien que le POR soit normalement trouvé en association avec des membranes, lorsque le POR recombinant est exprimé dans des bactéries, il ne nécessite pas d'association membranaire pour son activité.
Le NADPH est le donneur d'électrons proximal dans la photoréduction catalysée par POR du protochlorophyllide, et l'hydrure pro-S du NADPH est transféré au C-17 du pigment. Le proton introduit dans le C-18 du produit est dérivé de H2O. Un seul photon est nécessaire pour la réaction. Un intermédiaire de réaction qui absorbe au maximum à 695 nm a été détecté spectralement, mais sa structure n'a pas été déterminée. Une fois la réduction terminée, le produit NADP + est échangé contre une molécule de NADPH, puis le chlorophyllide est libéré de l'enzyme. Contrairement aux suggestions antérieures selon lesquelles le POR est une flavoprotéine, les POR de pois et de cyanobactéries exprimés actifs ne contiennent pas de cofacteur de flavine, même si l'enzyme est inhibée par l'antagoniste de la flavine quinacrine. Des expériences de spécificité de substrat ont montré que le pigment de substrat doit avoir un acide carboxylique C-17 libre. Les protochlorophyllides mono- et di-vinyliques étaient des substrats efficaces, mais le protochlorophyllide a ', qui a une configuration inversée au niveau de l'atome de carbone chiral dérivé de C-132 dans le cycle isocyclique, ne l'était pas. Le dérivé sans métal du protochlorophyllide n'est pas un substrat, et parmi les nombreux pigments à substitution métallique testés, seul le Zn-protochlorophyllide était actif en tant que substrat. Le Zn-protochlorophyllide b était également un substrat, même si le Mg-protochlorophyllide b ne l'était pas.
La plupart ou toutes les plantes angiospermes ont au moins deux gènes POR, et les produits de ces gènes ont des rôles différents dans le verdissement des tissus étiolés et le maintien de niveaux inférieurs de synthèse de chlorophylle à des stades de développement ultérieurs. Plusieurs gènes POR sont également présents dans certains gymnospermes qui peuvent former de la chlorophylle dans l'obscurité, mais différents rôles pour les produits de ces gènes n'ont pas été rapportés. Un seul gène codant pour POR est présent dans d'autres organismes qui peuvent former de la chlorophylle dans l'obscurité, y compris Synechocystis sp. PCC 6803 et Chlamydomonas.
Synonymes, antonymes
Voir tous les synonymes pour "protochlorophyllide".1 synonyme (sens proche) de "protochlorophyllide" :
- protochlorophyllide monovinyle
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à PROTOCHLOROPHYLLIDE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot PROTOCHLOROPHYLLIDE est dans la page 9 des mots en P du lexique du dictionnaire.
Mots en P à proximité
protocellule protocérébral protocérébronprotocerebrum protocerque protochlorophyllideprotocole protocorme protocyanine protocyte protoderme
En rapport avec "protochlorophyllide"
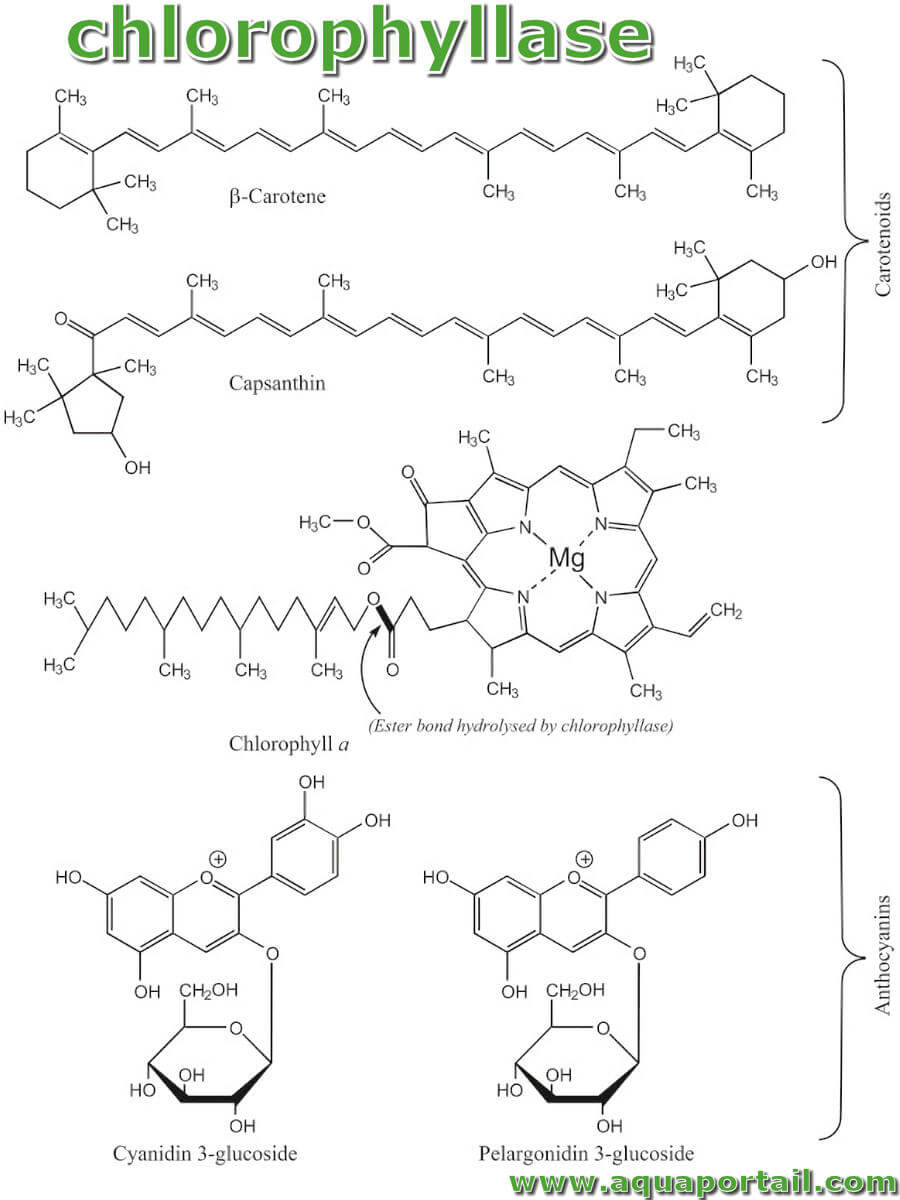
La chlorophyllase est l'enzyme qui catalyse la première étape de la dégradation de la chlorophylle en éliminant le groupe phytol, ce qui entraîne la formation...

La chlorophylle confère aux végétaux leur couleur verte grâce à des pigments verts présents dans les chloroplastes.
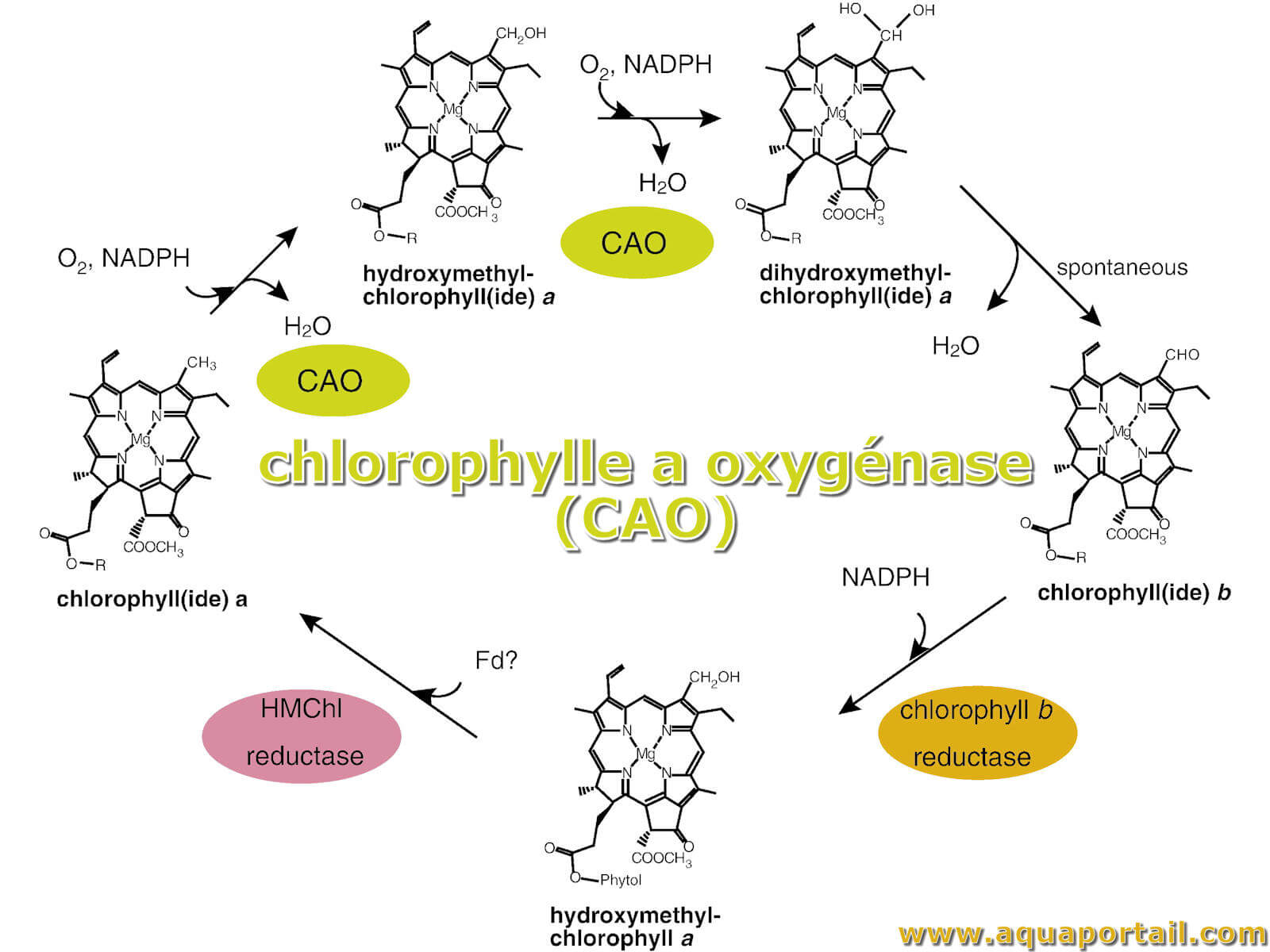
La chlorophylle a oxygénase (CAO) est une enzyme qui catalyse la synthèse de la chlorophylle b à partir de la chlorophylle a.
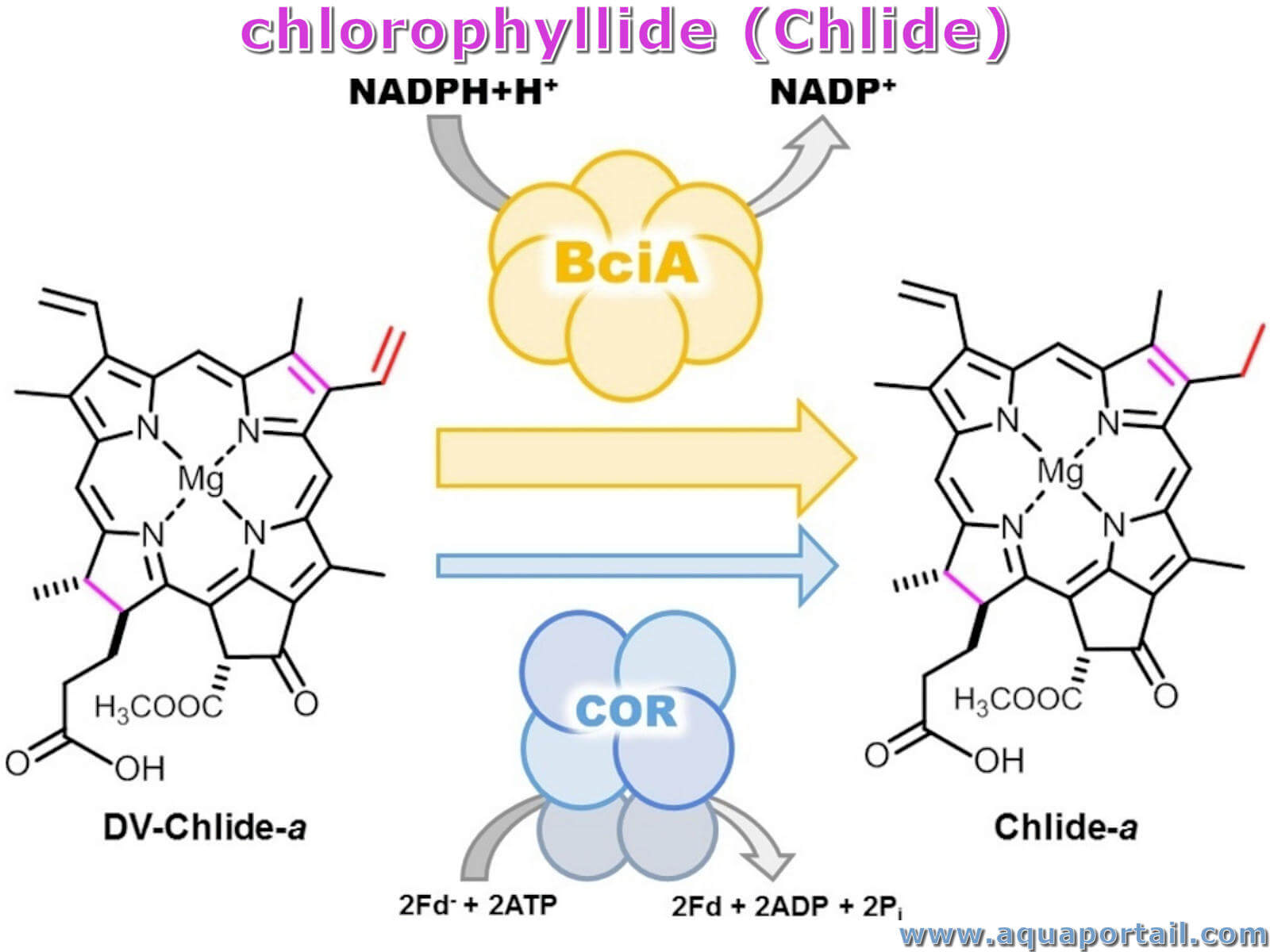
Le chlorophyllide est connu comme un dérivé de la chlorophylle verte, une chlorophylle a dépourvue de sa chaîne latérale phytyle.
