Topoisomérase
Définition
Une topoisomérase est une enzyme responsable des modifications de la topologie des molécules d'ADN requises dans le surfilage. Il y a deux classes principales : le type I (sous-classes de topoisomérase I et III) et le type II chez les eucaryotes (topoisomérases II et IV) qui, chez les bactéries, correspond à l'enzyme gyrase.
La topoisomérase II :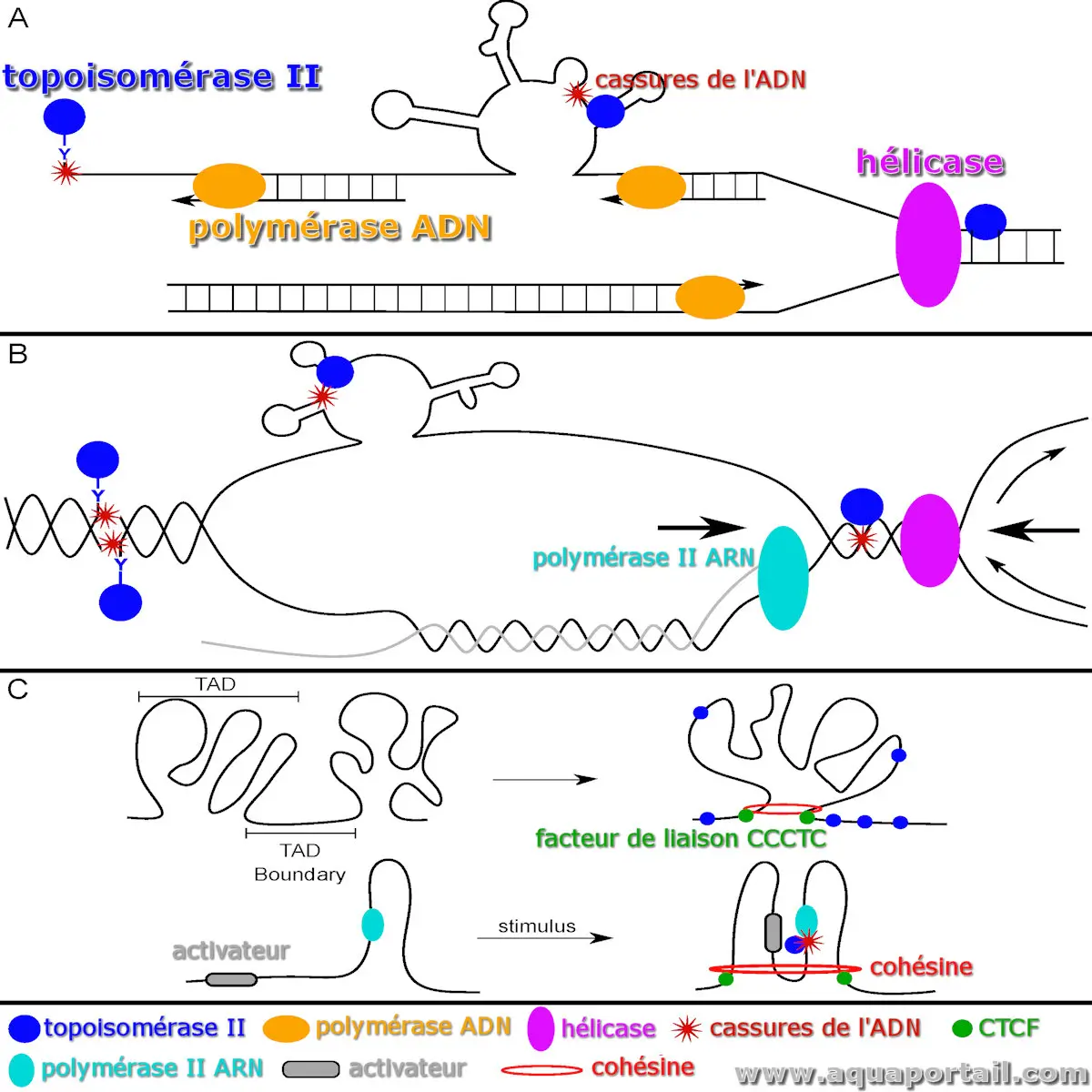
Les topoisomérases sont des enzymes essentielles qui régulent la structure de l'ADN en gérant sa torsion et ses liaisons. Elles s'attaquent à des problèmes tels que les enchevêtrements et les noeuds dans la double hélice compactée. Les topoisomérases de type I coupent un brin d'ADN, tandis que celles de type II coupent les deux brins pour permettre le passage des segments. Ces enzymes sont essentielles à des processus tels que la réplication de l'ADN, la transcription et la ségrégation des chromosomes. Le clivage de l'ADN topoisomérase II (TOP2) est nécessaire à de nombreux processus biologiques.
Explications
Les topoisomérases sont une catégorie d'enzymes appartenant à la classe des isomérases qui régulent le métabolisme de l'ADN, découvertes par James Wang et Martin Gellert pour l'ADN topo-isomérase. En particulier, les topoisomérases déterminent une augmentation ou une diminution du degré de surenroulement. Ces enzymes jouent un rôle fondamental dans le conditionnement et la réplication de l'ADN. Plus en détail, ils sont capables d'introduire temporairement un brin d'ADN simple ou double.
Les topoisomérases sont des enzymes essentielles à la régulation de la topologie de l'ADN. Elles éliminent les phénomènes de surenroulement, de noeuds et d'enchevêtrements qui surviennent lors de processus cellulaires comme la réplication et la transcription de l'ADN. Ces enzymes facilitent cette régulation en cassant et en rejoignant de manière transitoire un brin d'ADN (type I) ou les deux brins (type II), permettant ainsi à l'ADN de se dérouler et d'assurer la continuité des fonctions cellulaires.
Les topoisomérases sont des cibles importantes pour les thérapies anticancéreuses. Ces traitements agissent en stabilisant l'enzyme dans un complexe de clivage de l'ADN, induisant la mort cellulaire.
Fonctions
L'acide désoxyribonucléique (ADN) est une molécule trop complexe et extrêmement longue pour être facilement contenue dans un contenant biologique tel qu'une cellule (dans le cas des procaryotes) ou un noyau (chez les eucaryotes). Une topoisomérase est un facteur de relaxation.
La longueur de l'ADN du chromosome d'Escherichia coli, par exemple, est de 1,7 mm, la longueur d'une cellule typique de la même bactérie n'étant que de 2 μm : plus de 800 fois plus petite que son propre ADN. Pour atteindre un degré de compacité pouvant être contenu dans l'ADN, garantissant l'accès rapide à l'information codée à l'intérieur de celui-ci, les cellules possèdent l'appareil de topoisomérase, dont la fonction est précisément d'introduire des super-enrobages dans le super-ADN. La topologie introduit une grandeur particulière, appelée numéro de liaison Lk, pour quantifier le degré de superenroulement : Lk augmente avec les super-bobines positives (levogiri) et diminue avec les supercoils négatives (dextrorotors).
Deux molécules d'ADN différant uniquement par un changement du nombre de liaison sont appelées topoisomères.
La stabilité dérivée de la configuration en double hélice de l'ADN réside naturellement dans le fait qu'il est très difficile, grâce à cette configuration, de séparer les deux brins, rendant indispensable l'action des hélicases ou d'autres enzymes pour permettre la transcription des séquences d'ADN codant protéines, ou même si les chromosomes vont être répliqués.
Dans le cas de chromosomes circulaires comme ceux des bactéries, dans lesquels la double hélice est jointe aux extrémités formant un cercle littéralement fermé, les deux brins sont topologiquement enroulés ou noués. C'est-à-dire que les boucles d'ADN identiques, mais avec des nombres de tours différents sur elles-mêmes, sont des topoisomères et ne peuvent être interconverties par aucun processus n'impliquant pas la rupture des deux brins d'ADN. Les topoisomérases catalysent et guident le détachement de l'ADN et l'étirement 3 créant des ruptures momentanées dans les brins d'ADN et en utilisant comme résidu catalytique une tyrosine très conservée sur le plan de l'évolution.
L'insertion d'un génome viral dans les chromosomes et d'autres formes de recombinaison génétique nécessite également l'action des topoisomérases.
Les deux topoisomérases :
À gauche, la topoisomérase I (une isomérase) est en combinaison avec de l'ADN, et à droite, avec la topoisomérase II.
Topoisomérase I
Deux cas se distinguent pour les topoisomérases de type I :
- Fonction de la topoisomérase I chez les bactéries : la topoisomérase bactérienne Je ne peux relaxer que les super enroulements négatifs. Il a besoin d'ions magnésium pour son activité. Les topoisomérases procaryotes I se lient de manière covalente à l'extrémité 5 'de la rupture du brin au moyen d'une liaison phosphotyrosine. Ceci conserve l'énergie de la liaison clivée et permet aux deux extrémités d'être recombinées après la topoisomérisation. L'enzyme n'a pas besoin d'énergie sous forme d'ATP pour son activité.
- Fonction de la topoisomérase I chez les eucaryotes : la topoisomérase eucaryote I détend à la fois l'ADN super enroulé positivement et négativement. Il se lie à l'extrémité 5′ (résidu de phosphate) de la rupture du brin au moyen d'un groupe hydroxyle d'un résidu de tyrosine et provoque la rotation des segments 3′. À la suite de la décristallisation des sections d'ADN juste lues, ce qui est nécessaire pour les processus de transcription et de réplication, le super enroulement dans les zones adjacentes de l'hélice entraîne automatiquement une torsion excessive de la double hélice de l'ADN, accompagnée de forces de torsion. Pour contrecarrer les forces de torsion, le surenroulement positif est relâché par la topoisomérase eucaryote de type I. La topoisomérase de type I provoque une rupture simple brin sans consommer d'ATP. À son départ de l'ADN, elle referme la pause. Par la suite, la topoisomérase I et IV élimine les déviations négatives de l'état tordu et rétablit ainsi l'état physiologique normal.
Topoisomérase II
Pour le type II, il se distingue encore deux cas :
- Fonction de la topoisomérase II chez les bactéries : la topoisomérase II bactérienne provoque un surenroulement négatif de l'ADN. Cela leur permet de relaxer l'ADN surenroulé positivement et d'introduire une torsion négative dans l'ADN détendu. Il induit des cassures double brin; le supercoiling négatif intervient sous la consommation d'ATP.
- Fonction de la topoisomérase II eucaryote alpha : la topoisomérase II alpha eucaryote peut relaxer les surenroulements positifs et négatifs par une rupture double brin avec la consommation d'ATP. D'une part, les topoisomérases de type II neutralisent les forces de torsion mentionnées ci-dessus et influencent d'autre part l'agencement spatial de l'ADN. Dans le cadre de la consommation d'ATP, ils génèrent une rupture temporaire d'ADN double brin, de sorte qu'une partie d'hélice adjacente peut traverser l'espace formé. Cela permet des ordres complets de chromatine.
Dans l'image de la topoisomérase en haut :
- (A) Lors de la réplication de l'ADN, TOP2 élimine le surenroulement positif près de la fourche de réplication. Sur le brin matrice retardataire, l'ADN simple brin peut adopter des structures secondaires alternatives, possibles cibles de TOP2. Les collisions entre l'ADN polymérase et un complexe de clivage TOP2 (TOP2cc) déjà présent peuvent entraîner des cassures.
- (B) Pendant la transcription, TOP2 réduit le surenroulement négatif derrière l'ARN polymérase II (Pol II). En cas d'échec de la religation, des complexes TOP2cc peuvent se former. Le brin non matrice peut aussi développer des structures secondaires alternatives, susceptibles d'être clivées par TOP2. Par ailleurs, les collisions entre transcription et réplication, amplifiées par le surenroulement élevé, augmentent le risque de cassures impliquant TOP2.
- (C) TOP2 aide à maintenir l'organisation de la chromatine en atténuant le superenroulement aux frontières du CTCF et des domaines topologiquement associés (TAD) définis par la cohésine. Lors de l'activation transcriptionnelle, TOP2 est lié à des cassures d'ADN au niveau des sites d'initiation (SIT) des gènes activés par un activateur.
ADN topoisomérase
Un ADN topoisomérase, ou un facteur de relaxation en biologie, qualifie une enzyme qui catalyse la modification de la topologie de l'ADN. Les topoisomérases (type I : EC 5.99.1.2 et type II : EC 5.99.1.3) sont des enzymes capables d'agir sur la topologie de l'ADN, soit en l'enchevêtrant pour permettre un stockage plus compact ou en le démêlant pour contrôler la synthèse. des protéines et pour en faciliter la réplication. Ces enzymes sont nécessaires en raison des problèmes inhérents causés par la configuration structurelle de l'ADN.
L'ADN topoisomérase de type II est appelé l'ADN gyrase.
L'ADN a une structure sous la forme d'une double hélice dans laquelle deux brins ou chaînes de sucre 2-désoxyribose reliés par des ponts phosphate sont superposés, avec quatre bases, l'adénine, la thymine, la cytosine et la guanine. Le creux central de cette hélice ressemble presque aux marches d'un escalier en colimaçon, cette structure permet de conserver le matériel génétique de manière stable. Mais déjà Watson et Crick avaient remarqué que les deux brins d'ADN étaient roulés et tordus l'un sur l'autre, ce qui nécessiterait nécessairement un mécanisme capable de développer et de séparer les brins pour permettre l'accès aux informations stockées.
Synonymes, antonymes
Voir tous les synonymes pour "topoisomérase".2 synonymes (sens proche) de "topoisomérase" :
- gyrase
- TOP2
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à TOPOISOMÉRASE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot TOPOISOMERASE est dans la page 3 des mots en T du lexique du dictionnaire.
Mots en T à proximité
tophule tophuleux topoclimat topodème topographie topoisomérasetopologie toposéquence topotype tornade tornus
En rapport avec "topoisomérase"
Une gyrase est une enzyme qui modifie l'orientation spatiale des molécules d'ADN fermées. Elle appartient aux topoisomérases de type II qui, dans les cellules...

Une isomérase est une enzyme qui catalyse les réactions d'isomérisation, qui est la conversion d'un composé en une structure isomérique.

L'ADN polymérase est une enzyme cellulaire ou virale qui lie les nouveaux nucléotides au brin d'ADN naissant lors du processus de la réplication de l'ADN.
Une ARN polymérase (ARNP) est une enzyme qui se lie aux promoteurs de l'ADN puis catalyse la synthèse des ARN lors de la transcription.
