Carbocation
Définition
Un carbocation est un ion avec un atome de carbone chargé positivement. Parmi les exemples les plus simples figurent le méthénium CH3+, le méthanium CH5+ et l'éthanium C2H7+. Certains carbocations peuvent avoir deux charges positives ou plus, sur le même atome de carbone ou sur des atomes différents. Par exemple, le dication d'éthylène C2H42+ a deux charges cationiques.
Les types de carbocations :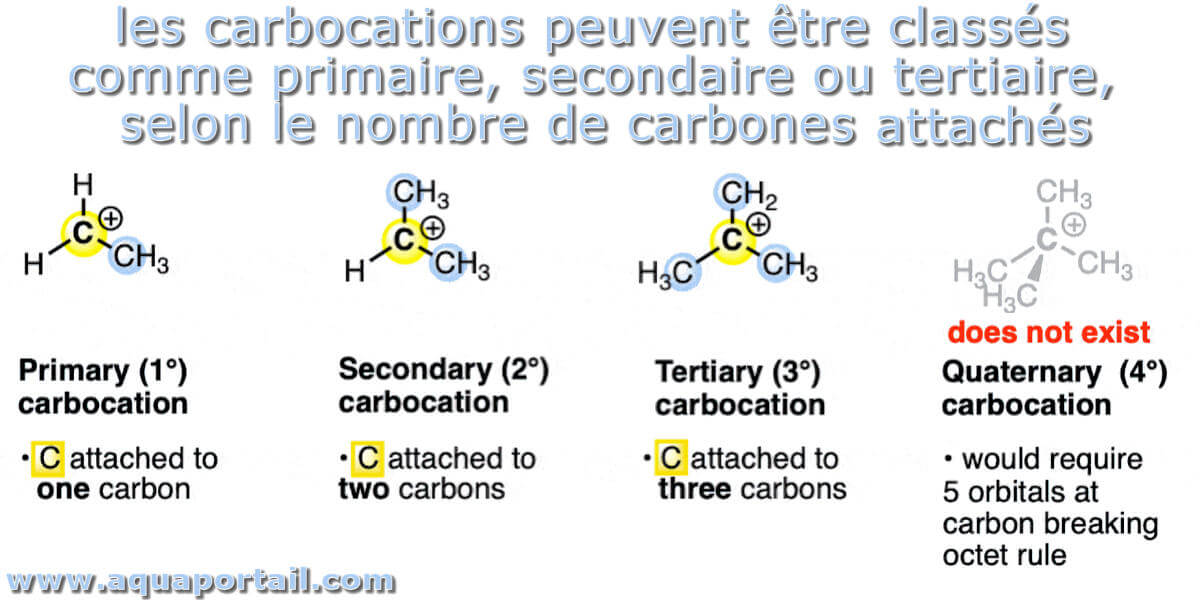
Un carbocation est une molécule dans laquelle un atome de carbone a une charge positive et trois liaisons. Nous pouvons dire que, fondamentalement, ce sont des cations de carbone. Les carbocations peuvent recevoir une désignation basée sur le nombre de groupes alkyle attachés au carbone du carbocation. Trois groupes alkyle sont appelés un carbocation tertiaire, 2 groupes alkyle sont appelés secondaires et 1 groupe alkyle est appelé primaire.
Explications
Les carbocations sont l'un des intermédiaires les plus importants de la chimie organique. Ils sont impliqués dans une grande variété de réactions, y compris des réactions de substitution, des réactions d'addition et des réactions d'élimination. La stabilité d'un carbocation est importante car elle détermine la vitesse et le mécanisme de ces réactions.
Les carbocations sont des électrophiles très actifs qui peuvent réagir avec une variété de nucléophiles dans l'ADN. Le troisième mécanisme de réticulation photoinduite de l'ADN se fait via un carbocation.
Les carbocations (ions carbonium) sont des espèces avec des centres de carbone chargés positivement et sont des électrophiles durs hautement réactifs. Lorsqu'ils se forment au cours du métabolisme des xénobiotiques, ils sont généralement de courte durée car ils peuvent facilement réagir avec l'eau pour former des alcools.
L'ion qui contient la charge positive sur l'atome de carbone est appelé carbocation. L'ion qui contient la charge négative sur l'atome de carbone est appelé carbanion.
La consitution est simple : l'hydrogène et les électrons dans sa liaison au carbone, mis en évidence en 4–1, se déplacent vers le carbone adjacent. Maintenant, le carbone dont est parti l'hydrure est déficient d'un électron et est donc un carbocation.
Types primaire, secondaire et tertiaire
Les carbocations peuvent être classés comme primaires, secondaires ou tertiaires en fonction du nombre de carbones directement attachés au carbone chargé positivement. Il est important de noter que les termes primaire, secondaire, tertiaire (et quaternaire) ne s'appliquent qu'aux carbones alkylés et aux carbocations. Lorsque le carbone participe à la liaison pi, différents noms sont appliqués.
Les carbocations quaternaires n'existent pas. Le problème est que l'orbitale p supplémentaire sur le carbone porterait le nombre d'orbitales sur le carbone à 5, violant la règle de l'octet.
Radicaux de carbone
Comme les carbocations, les radicaux sont des espèces déficientes en électrons. Un radical carboné a sept électrons dans la couche de valence contrairement à six électrons pour les carbocations. Comme les carbocations, les radicaux carbonés sont stabilisés par l'effet inductif de groupements liés au centre du radical. Parce que les radicaux ne sont pas aussi déficients en électrons que les carbocations, les différences de stabilité des radicaux sont plus petites que pour les carbocations.
L'ordre de stabilité des radicaux carbonés est parallèle à l'ordre de stabilité des carbocations. Comme un carbocation, un radical carboné possède un atome de carbone trivalent hybride sp2. Le radical méthyle a une structure plane avec des angles de liaison H-C-H de 120 °. L'atome de carbone trivalent a également une orbitale 2p non hybridée qui est perpendiculaire au plan des liaisons CH. Il contient l'électron non apparié.
Réarrangement des carbocations
Les carbocations ont tendance à se réorganiser beaucoup plus facilement que les carbanions. Dans des conditions de réaction courantes, un carbocation se réorganise en un autre carbocation de stabilité égale ou supérieure. Par exemple, un carbocation secondaire se réarrangera en un carbocation tertiaire ou un carbocation secondaire différent, mais habituellement il ne se réarrangera pas en un carbocation primaire moins stable.
Cette généralisation n'est pas absolue, et comme il n'y a pas de barrière à haute énergie au réarrangement des carbocations, un réarrangement en un cation moins stable peut exister s'il offre la possibilité de former un produit plus stable.
Le méthane, le carbocation de méthyle, le méthanol et les halogénures de méthyle sont distincts de la convention de dénomination "primaire, secondaire, tertiaire".
Hétéroatomes
Les carbocations avec trois substituants hétéroatomiques attachés au carbone sont des intermédiaires de réaction populaires. Ils sont stabilisés par don d'électrons à partir de paires d'électrons isolées d'hétéroatomes dans les orbitales π vacantes sur le carbone. L'azote est le plus efficace des trois hétéroatomes communs (O, N, S) en ce qui concerne le don de paires d'électrons.
La présence d'une seule fonction azotée peut permettre au sel d'un carbocation formel d'être plus stable et isolable. Avec un attachement d'atome d'azote, il existe deux structures hybrides de résonance possibles, l'ion carbénium 1 (+ charge ve sur le carbone) et l'ion iminium 2 (+ charge ve sur l'azote). De tels composés sont généralement considérés comme ayant la charge sur l'azote.
Lorsque le carbocation a plus d'un attachement de fonction hétéroatomique, il existe d'autres possibilités de délocalisation de charge.
Isomérisation des carbocations
Étant donné que les carbocations avec un squelette carboné différent diffèrent fortement dans leur stabilité, ils sont sujets à l'isomérisation en raison de laquelle le plus stable de tous les carbocations possibles est formé. La charge sur l'atome de carbone facilite cette isomérisation. L'isomérisation des carbocations se traduit par l'apparition de produits dont la structure diffère de celle apparemment prédéterminée par la structure du réactif.
Par exemple, pour la déshydratation du n-butanol, on peut s'attendre à la formation de butène-1 mais du butène-2 se forme. La raison en est l'isomérisation d'une espèce intermédiaire, le carbocation. Une situation similaire est observée pour la déshydratation du 2-méthylbutanol-1.
L'alkylation des hydrocarbures aromatiques avec des halogénures d'alkyle RX en présence d'AlCl3 (selon Friedel-Crafts) passe également par l'intermédiaire R+ et, par conséquent, s'accompagne de l'isomérisation du carbocation, grâce à laquelle un mélange d'hydrocarbures aromatiques alkylés est formé. Par exemple, lors de l'alkylation du benzène avec du chlorure de n-propyle (AlCl3, 255 K), deux hydrocarbures se forment.
Synonymes, antonymes
Voir tous les synonymes pour "carbocation".2 synonymes (sens proche) de "carbocation" :
- ion carbénium
- ion carbonium
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à CARBOCATION sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot CARBOCATION est dans la page 2 des mots en C du lexique du dictionnaire.
Mots en C à proximité
carapace carbamate carbamyl-phosphate carbanion carbène carbocationcarbohémoglobine carbonacé carbonatation carbonate carbonate de calcium
En rapport avec "carbocation"

Une amine est généralement un groupe fonctionnel (groupe amino) dont l'atome d'azote possède un doublet non liant.

Un carbanion est une contraction d'un carbone sur un anion, avec une charge négative sur le carbone.
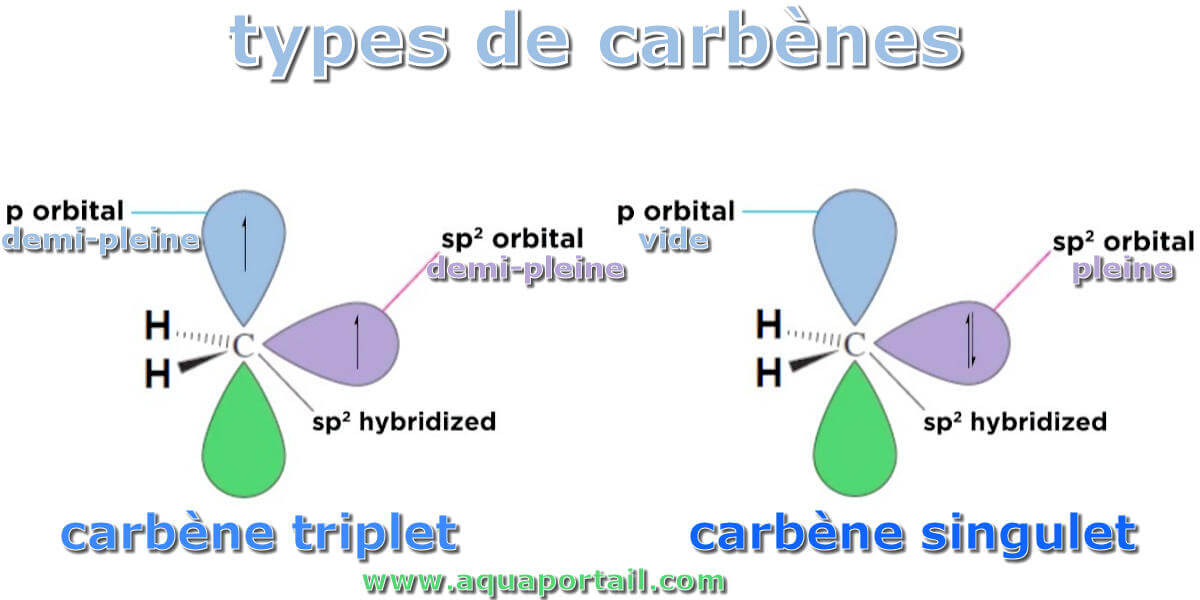
Le carbène est une espèce moléculaire avec des atomes de carbone formellement divalents et à deux coordonnées portant divers substituants X et Y et une seule...
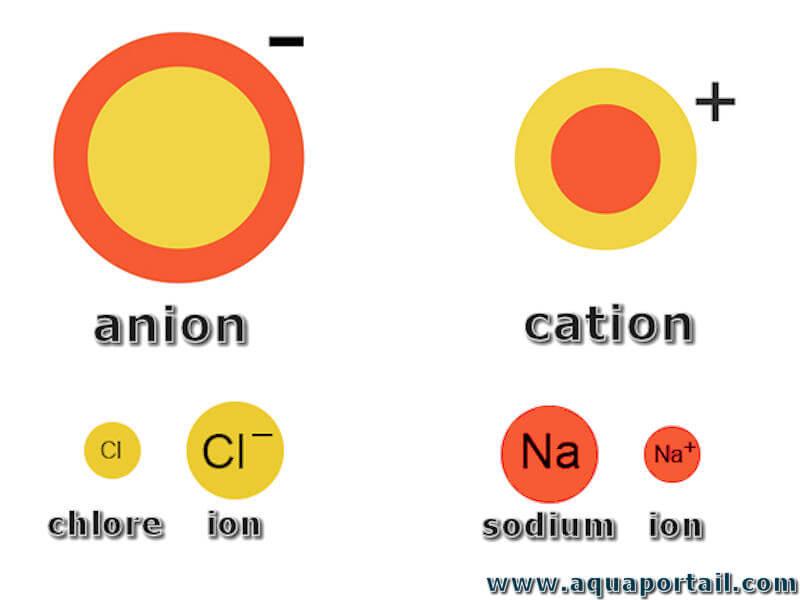
Un cation est un ion chargé positivement. L'origine de mot vient du déplacement des ions chargés positivement qui va toujours à la cathode pendant...
