Micelle
Définition
En chimie et biochimie, une micelle est le groupe de molécules qui constitue l'une des phases des colloïdes (comme une parcelle). C'est le mécanisme par lequel le savon solubilise les molécules insolubles dans l'eau, telles que les graisses. Les solutions colloïdales sont riches en micelles.
Une micelle avec un liposome :
Chaque molécule formant la micelle est représentée par une tête polaire et une queue non polaire. Une micelle est une structure microscopiquement petite d'un certain nombre de molécules d'un tensioactif (composé amphiphile) dans l'eau. Cela signifie qu'une partie de la molécule est hydrophile et qu'une partie est hydrophobe. La partie hydrophobe consiste habituellement en une longue chaîne hydrocarbonée et forme, pour ainsi dire, la queue de la molécule. La tête est alors hydrophile.
Micelle botanique
En botanique, une micelle est une petite particule fibrillaire, constituant de la paroi cellulaire. la paroi cellulaire, dans le bois, serait constituée de petits blocs de cellulose, les micelles, disposées un peu comme les briques constituant un mur et liées ensemble par une substance complexe à base de lignine.
Propriétés lipidiques
Dans un milieu de dispersion (généralement de l'eau), les molécules amphiphiles se lient les unes aux autres en raison de l'effet hydrophobe. Ce processus est appelé auto-assemblage. Les micelles forment au-dessus d'une certaine concentration en masse, la concentration micellaire critique (CMC), en raison de la propension des tensioactifs à se séparer des phases. Cela signifie que les parties hydrophiles (têtes) des molécules tensioactives s'alignent sur les molécules d'eau adjacentes, tandis que les parties hydrophobes (queues) s'agrègent et forment ainsi leur propre phase (voir schéma). Une telle micelle a typiquement une taille de quelques nanomètres, par exemple environ 4 nm pour une micelle SDS (dodécylsulfate de sodium) dans l'eau.
Si une solution contient des concentrations très élevées de substances tensioactives, les nombreuses micelles peuvent former des états d'ordre plus élevés, appelés cristaux liquides.
La formation de micelles se réfère également à l'agglomération d'asphaltènes dans des produits d'huile minérale, par exemple dans le fuel.
Micelle savon
Dans la formation d'une micelle de savon dans l'eau, les molécules de savon (un sel de sodium ou de potassium d'un acide gras) sont liées par leurs extrémités hydrophobes correspondant aux chaînes hydrocarbonées, tandis que leurs extrémités hydrophiles, celles qui ils portent les groupes carboxyle, ionisés négativement par la perte d'un ion sodium ou potassium, se repoussent l'un l'autre. De cette manière, les chaînes non-polaires du savon sont cachées à l'eau, tandis que les groupes carboxyle, chargés négativement, y sont exposés.
De même, les lipides polaires (comme les phospholipides) dans une solution aqueuse diluée sont dispersés pour former des micelles. Dans ceux-ci les chaînes d'hydrocarbure sont cachées de l'environnement aqueux et forment une phase hydrophobe interne, avec des groupes hydrophiles exposés sur la surface. Ces micelles peuvent contenir des milliers de molécules lipidiques et, par conséquent, leur masse est très élevée.
Dans les solutions aqueuses, les molécules amphiphiles forment des micelles dans lesquelles les groupes polaires sont en surface et les parties apolaires sont immergées à l'intérieur de la micelle, dans une disposition qui élimine les contacts défavorables entre l'eau et les zones hydrophobes et permet la solvatation (voir aussi la floculation) des groupes de la chaîne polaire. Dans un autre type de milieu, les molécules amphiphiles peuvent être organisées en micelles inverses.
Micelles inverses
Dans un solvant non polaire, l'exposition de la partie polaire n'est pas énergétiquement favorable. Dans ce cas, les groupes hydrophiles ont tendance à être dirigés vers l'intérieur de la micelle et les groupes hydrophobes sont exposés sur la surface. La formation de micelles inverses peut être assez difficile, car, parce qu'elles ont une charge électrique similaire, les amas polaires ont tendance à se repousser. Un exemple d'une micelle inverse est la bulle de savon. Cela peut être classé comme tel parce que, en raison de la caractéristique apolaire de l'air, la partie hydrophile de la micelle tourne vers l'intérieur et la partie hydrophobe, qui réagira avec l'air, vers l'extérieur.
Micellisation
La micellisation est un phénomène dynamique dans lequel n molécules de tensioactif monomère S s'associent pour former une micelle Sn : nS⇌Sn. La micellisation dépend de la température et présente une compensation enthalpie-entropie, l'entropie étant dominante à des températures plus basses et l'enthalpie plus importante à des températures plus élevées.
De scientifiques ont envisagé un équilibre dynamique dans lequel les molécules d'agent tensioactif monocaténaire quittent constamment les micelles tandis que d'autres molécules entrent dans la micelle. Des techniques expérimentales utilisant des méthodes cinétiques rapides telles que l'arrêt du flux, les sauts de température et de pression et la relaxation par ultrasons ont montré qu'il existe deux processus de relaxation pour l'équilibre micellaire.
La concentration micellaire critique (cmc) d'un amphiphile est la concentration à laquelle les micelles apparaissent dans la solution à une température donnée. La température critique des micelles (cmT) est la température à laquelle les micelles apparaissent dans une solution amphiphile d'une concentration donnée. En principe, cette concentration représente la valeur cmc à la température T.
Synonymes, antonymes
Voir tous les synonymes pour "micelle".1 synonyme (sens proche) de "micelle" :
- molécule amphiphile
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à MICELLE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot MICELLE est dans la page 3 des mots en M du lexique du dictionnaire.
Mots en M à proximité
miARN miasme mica micaschiste micellaire micellemicellisation micraster micro-atoll micro-guppy micro-injection
En rapport avec "micelle"
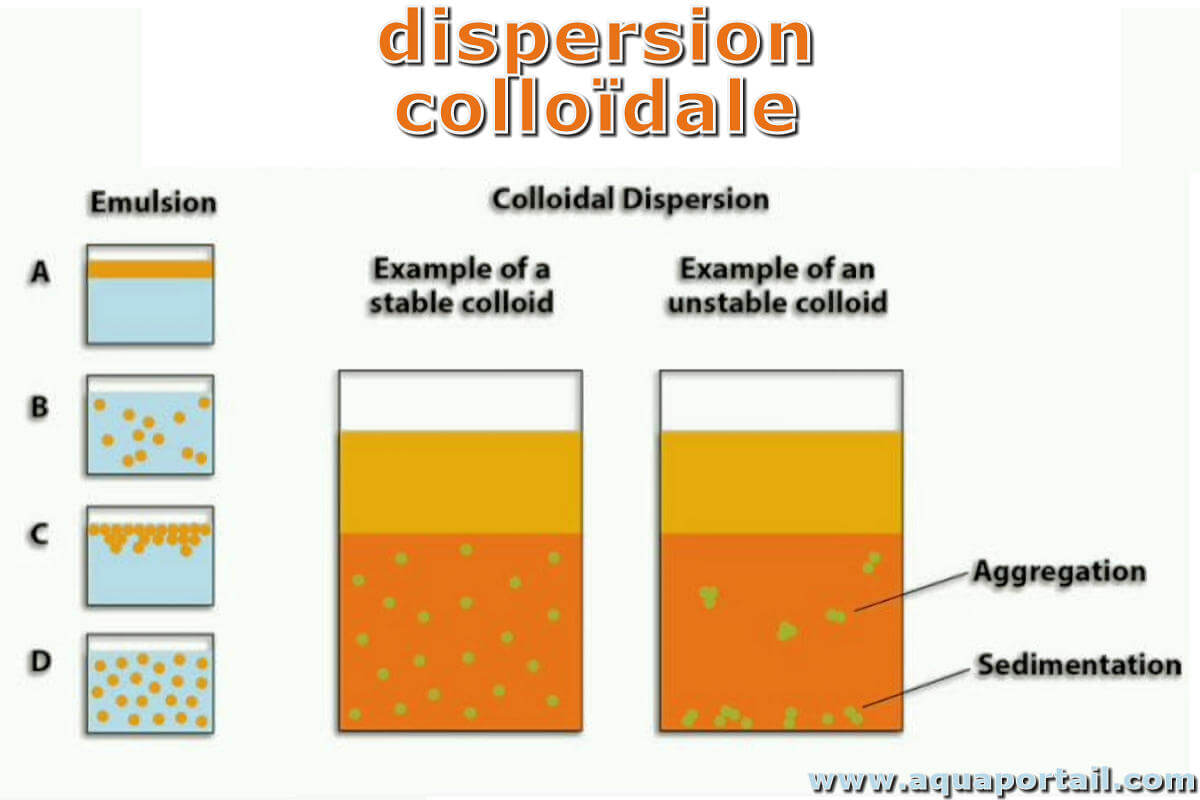
Colloïdal précise ce qui est de la nature des colloïdes. Les substances colloïdales sont celles qui provoquent le jaunissement de l'eau, surtout en aquarium...

En physique et en chimie, un colloïde ou un système colloïdal en suspension, est un système comportant deux phases ou plus, généralement un fluide (liquide)...

Un état colloïdal correspond à un état de dispersion de la matière au sein d'un liquide, caractérisé par des granules de dimension moyenne, comprise...

Une molécule est un groupe d'atomes solidement liés entre eux pour former le plus petit échantillon d'un corps pur (élément simple ou composé).
