Oxydoréduction
Définition
L'oxydoréduction est une réduction d'oxyde ou simplement une réaction redox à toute réaction chimique dans laquelle un ou plusieurs électrons sont transférés entre les réactifs, provoquant une modification de leurs états d'oxydation. Par exemple, la rouille d'un métal est une oxydoréduction, à savoir l'oxydation du fer.
Du métal oxydé par oxydoréduction :
L'oxydoréduction a corrodé et oxydé ce morceau de métal, et selon la composition du métal, il se forme de la rouille.
Réaction d'oxydo-réduction
Pour qu'il y ait une réaction de réduction-oxydation, il doit y avoir dans le système un élément qui donne des électrons, et un autre qui les accepte :
- L'agent oxydant est cet élément chimique qui tend à capturer ces électrons, le laissant avec un état d'oxydation inférieur à celui qu'il avait, c'est-à-dire en étant réduit.
- L'agent réducteur est cet élément chimique qui fournit des électrons de sa structure chimique au milieu, augmentant son état d'oxydation, c'est-à-dire étant oxydé.
Une réaction d'oxydoréduction :
La réaction d'oxydoréduction (réaction redox) entre le fluor et l'hydrogène dans lequel l'hydrogène (réducteur) dégage des électrons et le fluor (oxydant) les absorbe; dans ce processus, le fluorure d'hydrogène est formé.
Lorsqu'un élément chimique réducteur donne des électrons au milieu, il devient un élément oxydé, et la relation qu'il entretient avec son précurseur est établie par ce qu'on appelle une paire redox. De manière analogue, il est dit que lorsqu'un élément chimique capte des électrons du milieu, il devient un élément réduit et forme également une paire redox avec son précurseur oxydé. Quand une espèce peut être oxydée, et en même temps réduite, on l'appelle un ampholyte, et le processus d'oxydo-réduction de cette espèce est appelé ampholyse.
Principe de l'électroneutralité
Le principe d'électroneutralité de Pauling (échelle de Pauling) correspond à une méthode d'approximation pour estimer la charge sur des molécules ou des ions complexes; ce principe suppose que la charge est toujours distribuée dans des valeurs proches de 0 (c'est-à-dire -1, 0, +1).
Dans une réaction redox globale, il existe une série de réactions particulières appelées demi-réactions ou réactions partielles :
- Demi-réaction de réduction : 2e- + Cu2+ → Cu0;
- Demi-réaction d'oxydation : Fe0 → Fe2+ + 2 e-.
La tendance à réduire ou oxyder d'autres éléments chimiques est quantifiée par le potentiel de réduction, également appelé potentiel rédox.
Un titrage redox est un titrage dans lequel un indicateur chimique indique la variation du pourcentage de la réaction redox par le changement de couleur entre l'oxydant et le réducteur.
Oxydoréduction biologique
Dans le métabolisme de tous les êtres vivants, les processus redox sont d'une importance primordiale, puisqu'ils sont impliqués dans la chaîne des réactions chimiques de la photosynthèse et de la respiration aérobie. Dans les deux réactions, il existe une chaîne de transport d'électrons formée par une série de complexes enzymatiques, parmi lesquels les cytochromes se distinguent; ces complexes enzymatiques acceptent (réduisent) et produisent (oxydent) des paires d'électrons de façon séquentielle, de sorte que le premier produit des électrons à la seconde, celui-ci à la troisième, etc., jusqu'à un accepteur final qui est définitivement réduit; Pendant leur voyage, les électrons libèrent de l'énergie qui est utilisée pour synthétiser des liaisons à haute énergie sous forme d'ATP.
Une oxydoréduction biologique d'une coenzyme :
Il y a une oxydoréduction du coenzyme FAD, sous forme de gain d'une paire d'atomes d'hydrogène (deux protons et deux électrons.
Un autre type de réaction redox fondamentale dans les processus métaboliques sont les déshydrogénations, dans lesquelles une enzyme (déshydrogénase) tire un couple d'atomes d'hydrogène vers un substrat; puisque l'atome d'hydrogène est constitué d'un proton et d'un électron, ledit substrat est oxydé (puisqu'il perd des électrons). Ces électrons sont captés par des molécules spécialisées, principalement des coenzymes NAD+, NADP+ et FAD que lorsque les électrons gagnants sont réduits, et ils les conduisent aux chaînes de transport d'électrons susmentionnés.
Le métabolisme implique des centaines de réactions d'oxydoréduction. Ainsi, le catabolisme sont des réactions dans lesquelles les substrats sont oxydés et les coenzymes sont réduites. Au contraire, les réactions d'anabolisme sont des réactions dans lesquelles les substrats sont réduits et les coenzymes sont oxydées. Dans l'ensemble, le catabolisme et l'anabolisme constituent le métabolisme.
Combustion
La combustion est une réaction chimique de réduction-oxydation, dans laquelle généralement une grande quantité d'énergie est dégagée, sous forme de chaleur et de lumière, se manifestant visuellement comme du feu.
Dans toute combustion, il y a un élément qui brûle (combustible) et un autre qui produit une combustion (oxydant), généralement de l'oxygène sous forme de dioxygène gazeux O2. Les explosifs ont de l'oxygène lié chimiquement, de sorte qu'ils n'ont pas besoin d'oxygène de l'air pour effectuer la combustion.
Les types de combustibles les plus courants sont les matériaux organiques contenant du carbone et de l'hydrogène (voir hydrocarbures). Dans une réaction complète, tous les éléments ont l'état d'oxydation le plus élevé. Les produits qui se forment sont du dioxyde de carbone (CO2) et l'eau, le dioxyde de soufre (SO2) (si le carburant contient du soufre) et des oxydes d'azote peuvent apparaître (NOx), en fonction de la température et de la quantité d'oxygène dans la réaction.
Conséquences et industrie
Dans les métaux, une conséquence très importante de l'oxydation avec l'oxydoréduction est la corrosion, phénomène d'impact économique très négatif, étant donné que les matériaux acquièrent ou modifient leurs propriétés en fonction des agents exposés et de la manière dont ils agissent sur eux.
En combinant les réactions d'oxydo-réduction (redox) dans une cellule galvanique, les cellules électrochimiques sont réalisées. Ces réactions peuvent être exploitées pour éviter des phénomènes de corrosion indésirables au moyen de la technique d'anode sacrificielle et pour obtenir un courant électrique continu.
Dans l'industrie, les procédés redox sont également très importants, tant pour leur utilisation productive (par exemple la réduction des minéraux pour l'obtention d'aluminium ou de fer) que pour leur prévention (par exemple dans la corrosion).
La réaction inverse de la réaction redox (qui produit de l'énergie) est l'électrolyse, dans laquelle de l'énergie est fournie pour dissocier les éléments de leurs molécules.
Synonymes, antonymes
Voir tous les synonymes pour "oxydoréduction".2 synonymes (sens proche) de "oxydoréduction" :
- oxydo-réduction
- réaction rédox
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à OXYDORÉDUCTION sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot OXYDOREDUCTION est dans la page 3 des mots en O du lexique du dictionnaire.
Mots en O à proximité
oxyde de graphène oxyde de zinc oxyde nitrique oxydo-réducteuroxydoréductase oxydoréductionoxygénase oxygénation oxygène oxygène dissous oxygène liquide
En rapport avec "oxydoréduction"
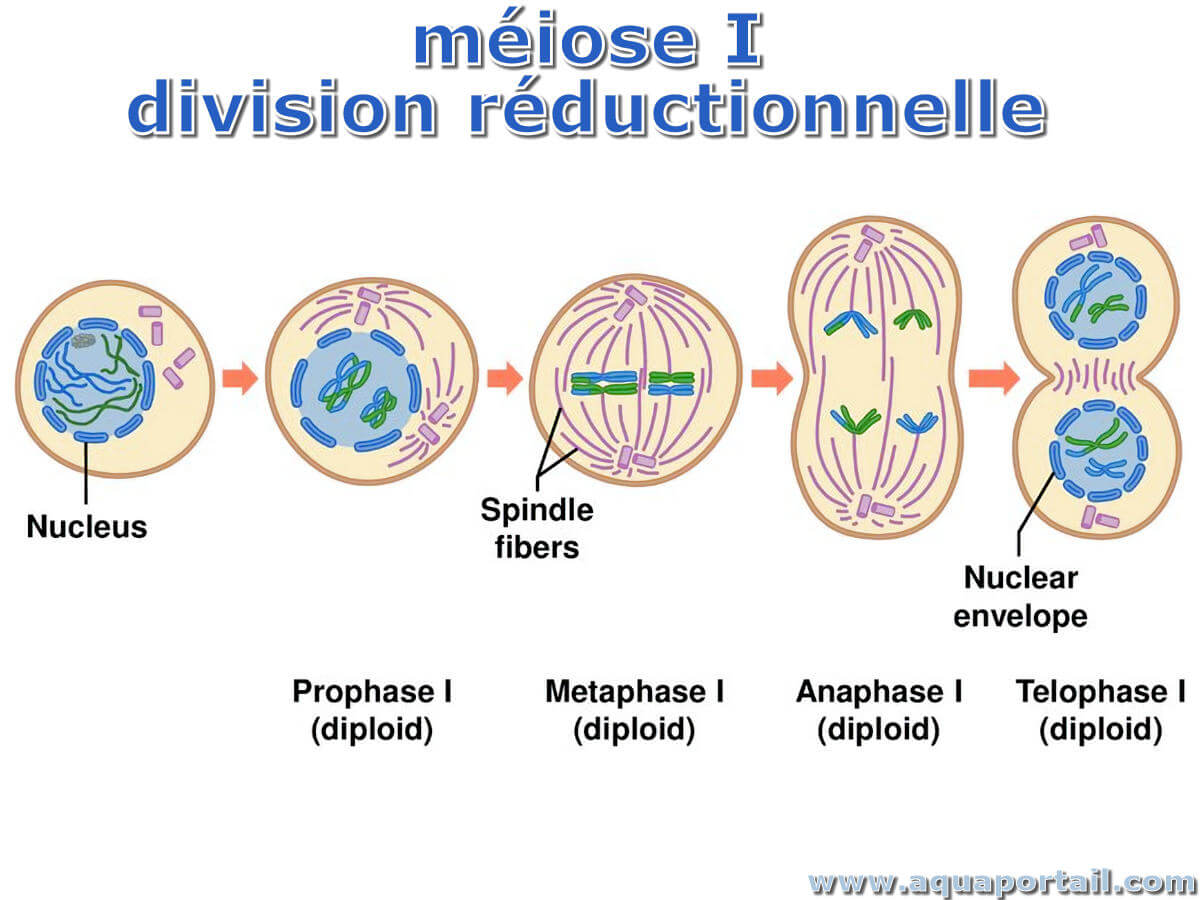
La division réductionnelle est la première division méiotique qui consiste en la séparation (ségrégation) des homologues de chaque paire chromosomique...
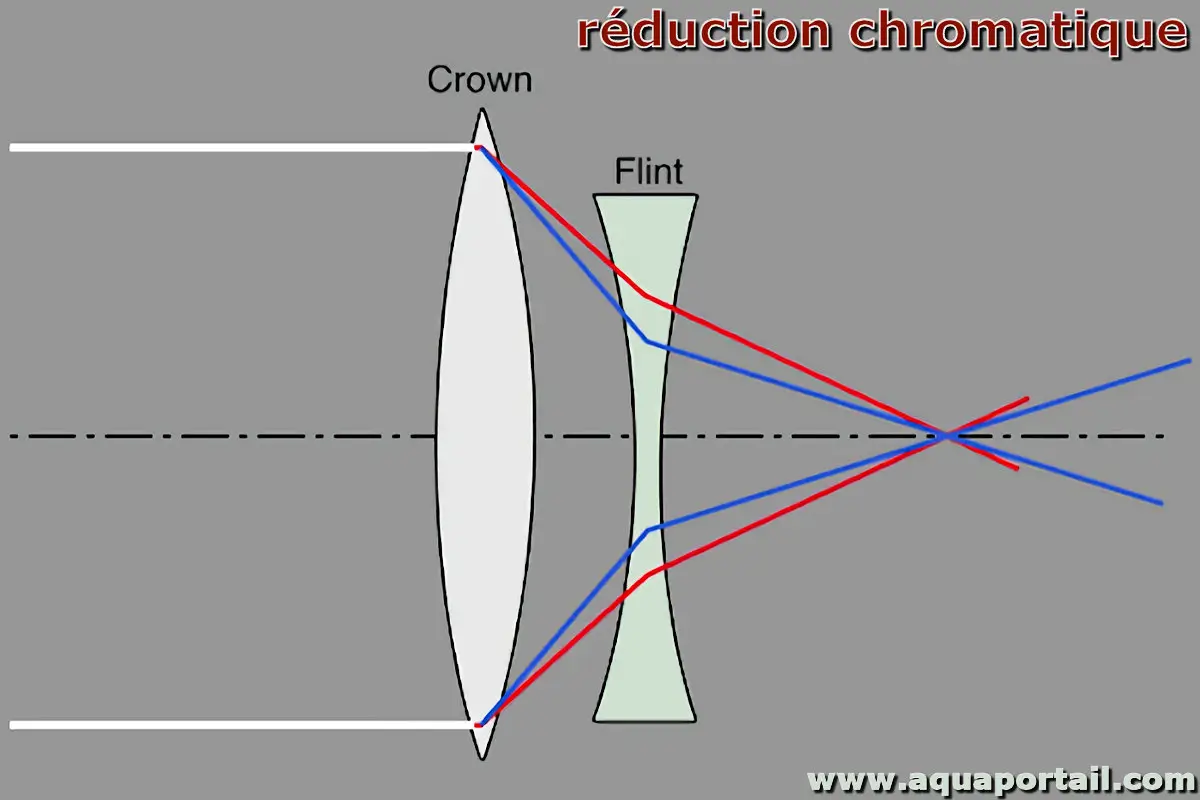
Une réduction chromatique est une réduction de l'aberration chromatique. L'aberration chromatique peut être réduite en augmentant la distance focale...
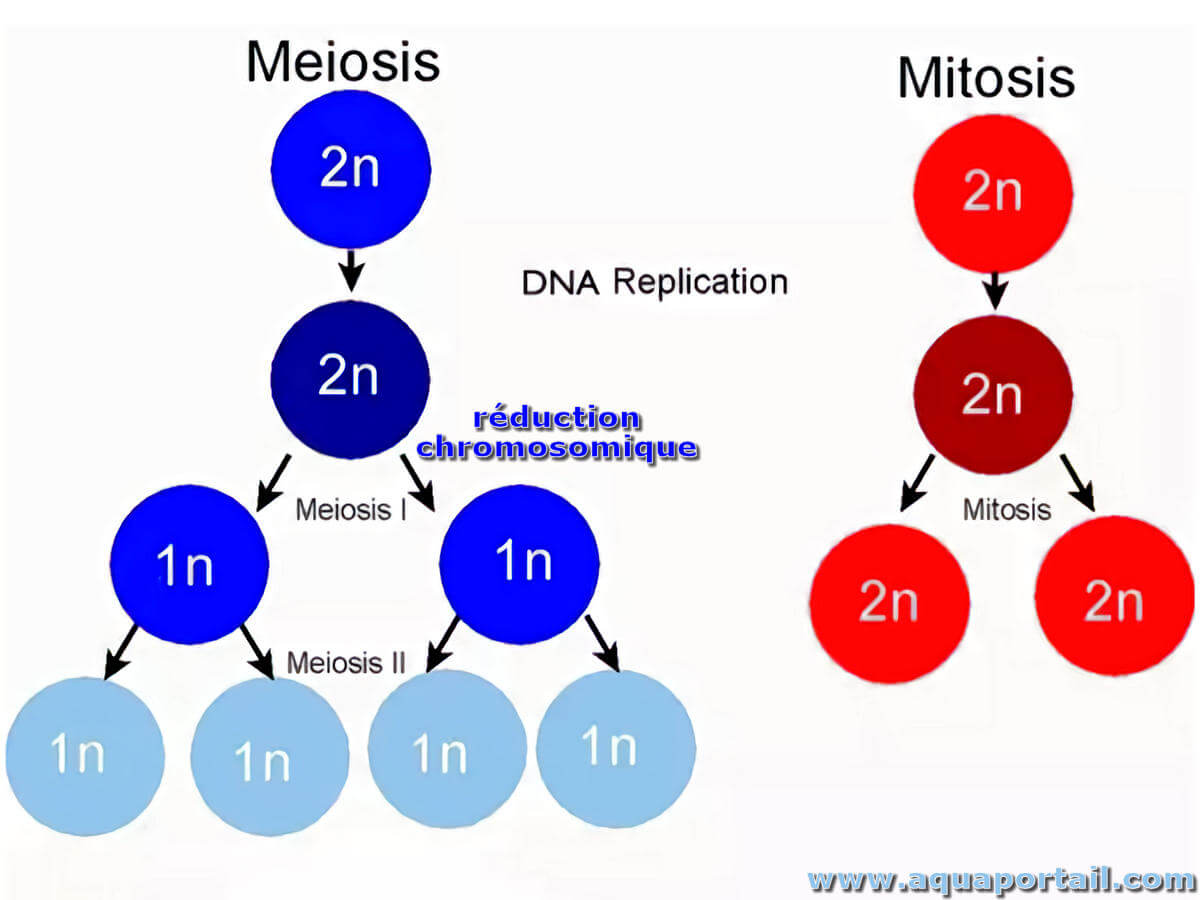
Une réduction chromosomique est une réduction de 2n (état diploïde) à n (état haploïde) du nombre de chromosomes au cours de la méiose. Elle...

En biologie, appliquée à la division cellulaire, réductionnelle est une division réductionnelle dans le cadre de la méiose ou de la mitose, il s'agit...
