TAP-1
Définition
TAP-1 et TAP-2 (transporteur 1 et 2) sont des protéines de transport de la membrane du réticulum endoplasmique rugueux (RER) permettant le passage des peptides du cytosol vers la lumière du RER.
Le transporteur associé au traitement antigénique (TAP) fournit des peptides dans le lumen du réticulum endoplasmique (RE) pour la liaison par des molécules du complexe majeur d'histocompatibilité (CMH) de classe I. TAP comprend deux polypeptides, TAP1 et TAP2, chacun étant un "demi-transporteur" codant pour un domaine transmembranaire et un domaine de liaison aux nucléotides.
Organisation structurelle des transporteurs TAP1 et TAP2 :
A, Organisation structurelle du transporteur TAP. La topologie de la membrane a été prédite sur la base d'alignements de séquences avec d'autres transporteurs ABC, notamment MDR1 et d'une analyse d'hydrophobie. Le pore de translocation est encadré par 2 × 6 hélices transmembranaires de TAP1 et TAP2 (cylindres bleus). Les régions N-terminales de TAP1 et TAP2 n'ont pas d'équivalent dans les autres protéines ABC. Ils contiennent respectivement quatre et trois hélices transmembranaires (cylindres orange). Le cercle jaune englobe le NBD hautement conservé avec les motifs Walker A (boucle P) et B (barres rouges) et la boucle C (barre bleue). Les boucles cytosoliques suivant TM6 et au sein de TM5 et TM6 des deux sous-unités délimitent le site potentiel de liaison du peptide. B, Disposition des hélices transmembranaires. Les hélices transmembranaires (bleu clair pour TAP1 et bleu foncé pour TAP2) sont organisées selon le modèle pour MDR1.
Explications
TAP1 et TAP2 sont deux membres "demi-transporteurs" de la superfamille ABC qui jouent un rôle essentiel dans la présentation à la surface cellulaire des peptides intracellulaires (par exemple, des peptides d'origine virale) aux cellules T cytotoxiques. Les protéines TAP1 et TAP2 forment un complexe hétérodimère fonctionnel dans la membrane du réticulum endoplasmique qui est responsable de la translocation dépendante de l'ATP de peptides courts (8 à 16 résidus) du cytosol vers la lumière du réticulum endoplasmique. Une fois délivrés à cet endroit, les peptides peuvent se lier aux protéines du CMH de classe I, qui les présentent à la surface cellulaire.
Le complexe TAP possède une activité ATPase stimulée par les peptides après reconstitution en protéoliposome, et on pense qu'il fonctionne de manière similaire à la Pgp, sauf que ses substrats peptidiques sont hydrophiles et devraient être situés principalement en phase aqueuse, avant le transport.
TAP2, mais pas TAP1, a la capacité de former un complexe homodimère à la fois dans des cellules entières et dans des lysats.
Les données indiquent que des sous-unités polypeptidiques TAP uniques possèdent de nombreuses caractéristiques de l'hétérodimère TAP, ce qui démontre qu'elles sont des modèles utiles dans l'étude des transporteurs de cassette de liaison à l'ATP.
Structure génétique
Les structures génomiques des gènes humains TAP1 et TAP2 ont été déterminées) et sont constituées de 11 exons chacune. 8 des 11 exons ont la même longueur et les 3 exons restants diffèrent en longueur de 100 (exon 1), 3 (exon 9) et 78 (exon 11) nucléotides. Les limites des exons pour les exons homologues de TAP1 et TAP2 sont du même type.
Il existe peu de conservation de la taille des introns entre les régions homologues des gènes TAP1 et TAP2. Bien que la structure génomique des TAP de rongeurs n'ait pas été déterminée, un alignement des séquences nucléotidiques correspondant à l'alignement des séquences d'acides aminés suggère que cet arrangement d'exons pourrait être préservé.
L'homologie est la plus élevée entre TAP1 de rat et de souris (79 % au niveau de l'ADN et 77 % au niveau des protéines).
Les TAP1 humains et de rats sont homologues à 76 % au niveau nucléotidique (70 % de protéines), et les TAP1 humains et murins sont homologues à 64 % au niveau nucléotidique (61 % de protéines). L'analyse phylogénétique indique que le degré de parenté entre les gènes humains TAP1 et TAP2 est similaire à celui entre chaque gène et son homologue équivalent chez le rongeur. Par conséquent, les TAP humains sont homologues à 64 % au niveau protéique.
Cette homologie est concentrée dans les régions codées par les exons 8 et 10. Ces exons codent pour des sections des domaines de liaison à l'ATP qui contiennent la caractéristiqueMotifs Walker A et B. L'homologie entre les exons équivalents restants est comprise entre 49 et 65 %.
En supposant la conservation de la structure des exons entre les espèces, les autres exons sont plus similaires entre les espèces qu'entre les TAP de la même espèce. Par exemple, les exons courts 3 et 6 du TAP1 humain seraient homologues à 72 et 85 % aux exons correspondants du rat, mais seulement à 65 et 49 % homologues aux exons correspondants du TAP2 humain. Cette observation peut avoir des conséquences importantes lorsqu'il s'agit de déterminer la relation entre la structure et la fonction du TAP.
Synonymes, antonymes
Voir tous les synonymes pour "TAP-1".1 synonyme (sens proche) de "tAP-1" :
- transporteur 1
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à TAP-1 sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot TAP-1 est dans la page 1 des mots en T du lexique du dictionnaire.
Mots en T à proximité
tangue tanin tannase tannosome tanycyte TAP-1tapetum taphonomie taphrophyte tapir tapir de Baird
En rapport avec "TAP-1"
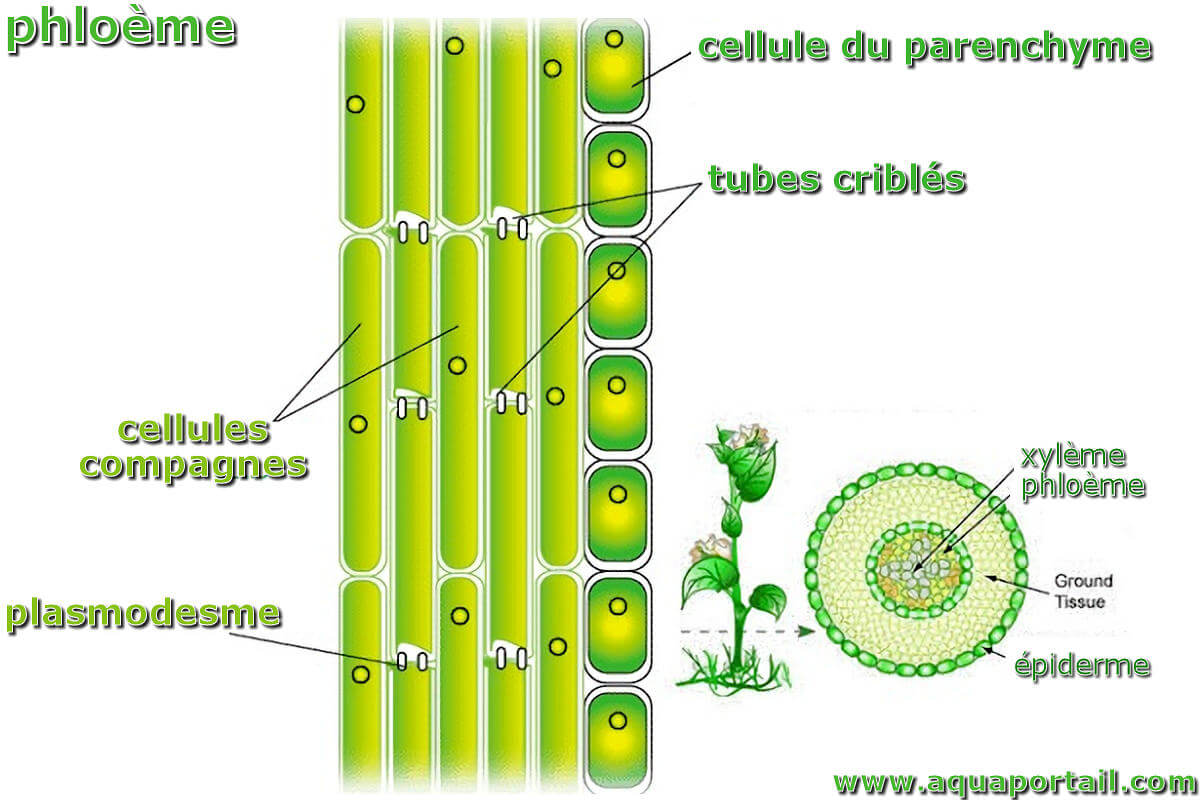
La translocation est initialement un transport à longue distance, comme la translocation de groupe, mais le terme prend différents sens selon le domaine...
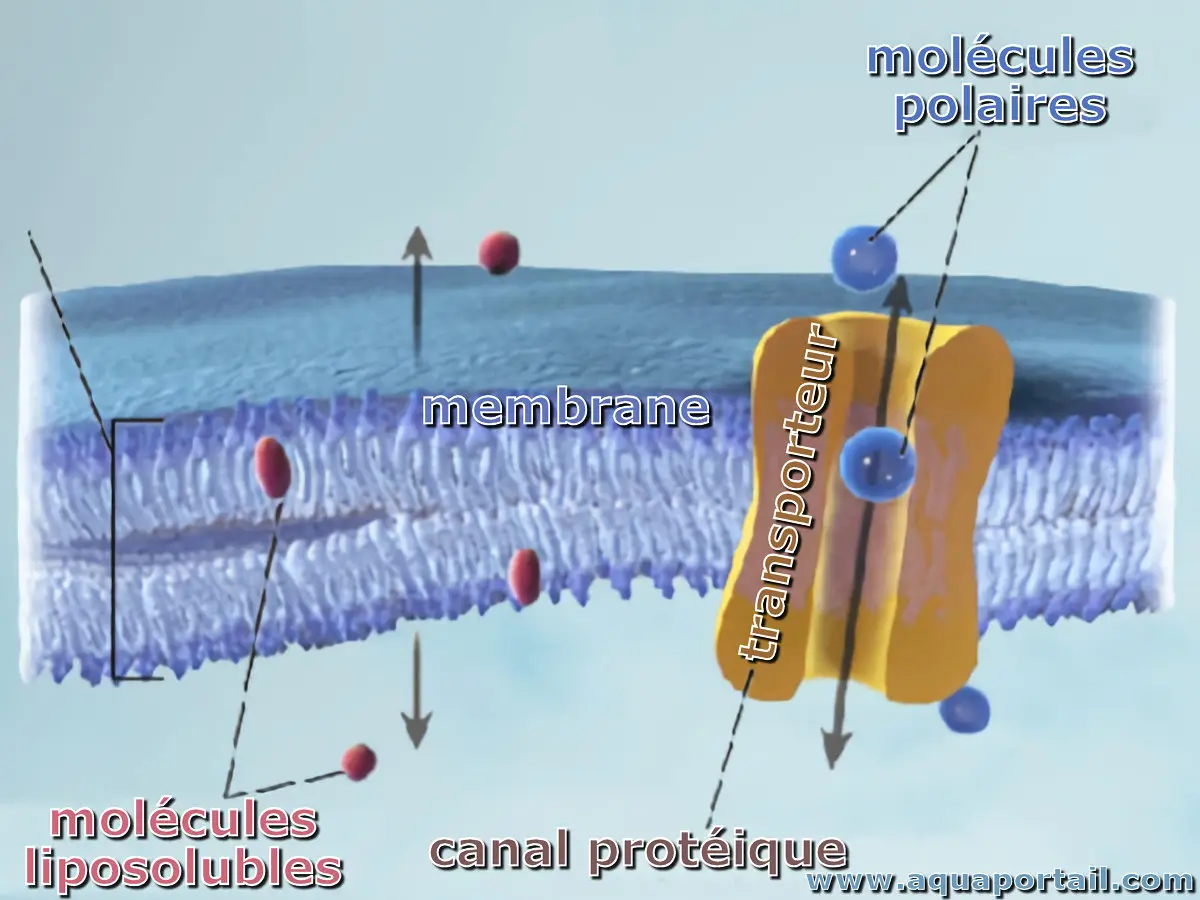
En biologie, un transporteur chimique ou biochimique est une protéine de la membrane plasmique qui se combine à une substance à transporter, tel qu'un...
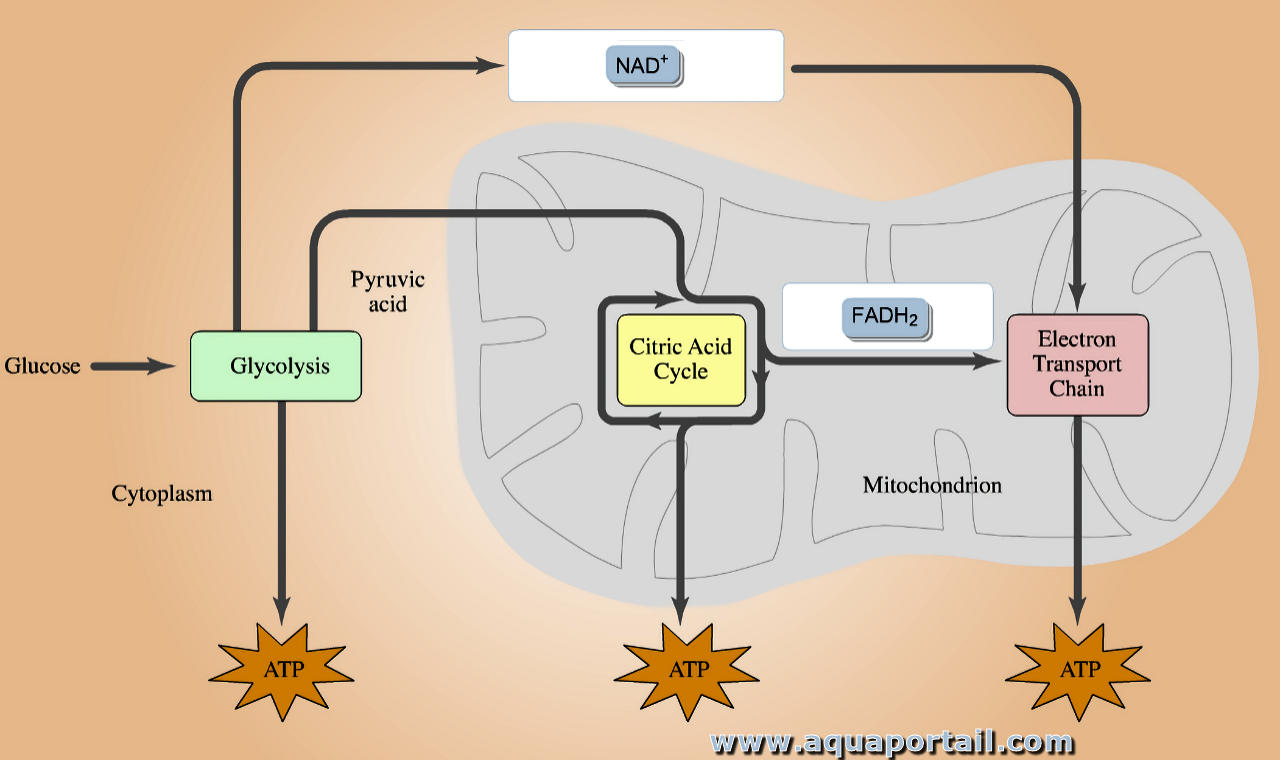
Un transporteur d'électrons qualifie chacune des molécules de la chaîne respiratoire mitochondriale ou de la chaîne photosynthétique chloroplastique...
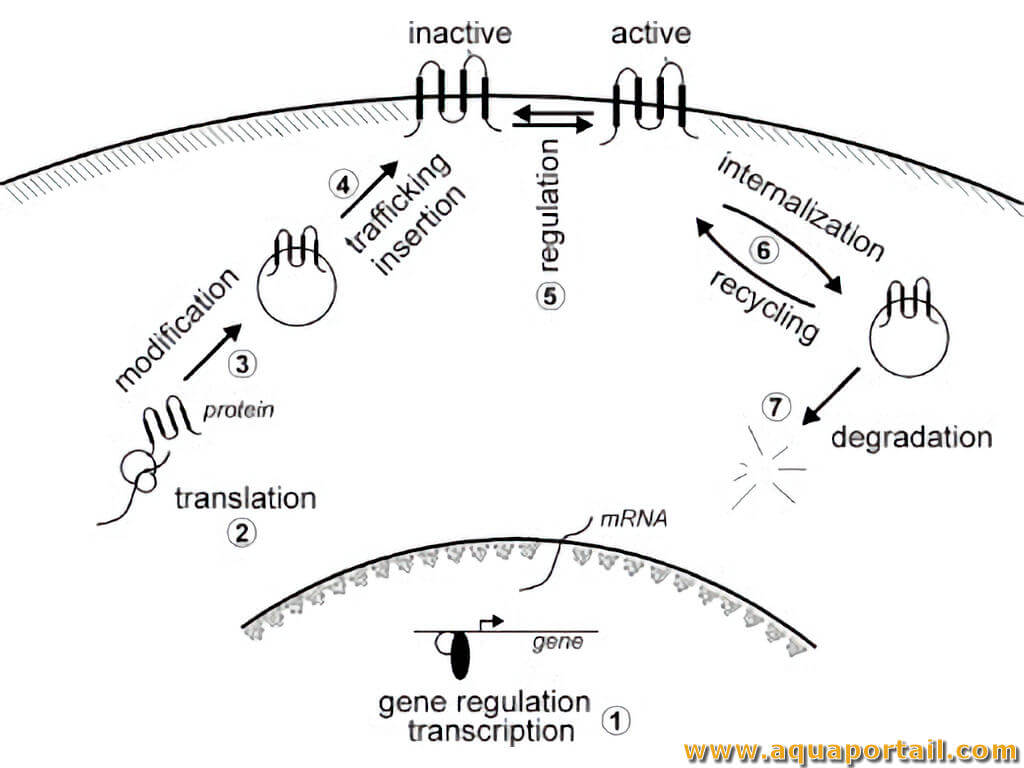
Un transporteur ionique est un transporteur d'ions constitué de dispositifs moléculaires, les protéines, situés au niveau des membranes cellulaires, notamment...
