Colloïde
Définition
En physique et en chimie, un colloïde ou un système colloïdal en suspension, est un système comportant deux phases ou plus, généralement un fluide (liquide) et un autre dispersé sous la forme de particules solides généralement très fines, d'un diamètre compris entre 10-9 et 10-5 m.
La mousse de bière est un système colloïdal :
Le colloïde de la bière est la mousse blanche, une sorte d'écume de la bière.
Explications
La phase dispersée des colloïdes est celle dans la plus petite proportion. Normalement, la phase continue est liquide, mais on peut trouver des colloïdes dont les composants se trouvent dans d'autres états d'agrégation de matière.
Voir aussi les phycocolloïdes, un état colloïdal et une solution colloïdale.
Généralités
Un colloïde est une substance gélatineuse qui ne peut être dialysée, comme le seston du milieu océanique. Un système colloïdal est le principal constituant de l'écume et en particulier de l'écume marine : c'est un corps gras.
Une suspension colloïdale est le nom donné aux dispersions de particules fines dans un milieu; le diamètre des particules entre 1 et 1 000 nm. Dans les sols : particule de très petite dimension (de 0,5 à 1 micron), soit minérale (par exemple argile colloïdale), soit organique (par exemple humus).
Les dispersions colloïdales se présentent sur des surfaces relativement grandes.
Une propriété à noter : les particules colloïdes ont généralement la propriété d'attirer fortement à leur surface divers minéraux.
Le nom de "colloïde" ou d'une solution colloïdale vient de la racine grecque kolas qui signifie "qu'il peut coller". Ce nom fait référence à l'une des propriétés principales des colloïdes : leur tendance spontanée à ajouter ou à former des caillots. De là vient également le mot "cola", le fluide pâteux utilisé pour coller.
Les colloïdes affectent également le point d'ébullition de l'eau et sont polluants.
Les colloïdes diffèrent des suspensions chimiques, principalement par la taille des particules de la phase dispersée. Les particules dans les colloïdes ne sont pas directement visibles, elles sont visibles au niveau microscopique (entre 1 nm et 1 µm) et dans les suspensions chimiques, elles sont visibles au niveau macroscopique (plus de 1 µm).
De plus, au repos, les phases d'une suspension chimique se séparent, contrairement à celles d'un colloïde. La suspension chimique est filtrable, alors que le colloïde n'est pas filtrable.
Les systèmes colloïdaux sont des systèmes non homogènes dans lesquels les particules constituant un ou plusieurs de leurs composants (phase dispersée ou dispersée) ont des tailles comprises entre 10 et 2000 Å, tandis que les composants restants sont constitués de particules inférieures à environ 10 Å (phase dispersante ou milieu de dispersion).
Dans certains cas, les particules sont de grosses molécules, comme des protéines. Dans la phase aqueuse, une molécule est pliée de telle sorte que sa partie hydrophile se trouve à l'extérieur, c'est-à-dire la partie qui peut former des interactions avec les molécules d'eau par le biais de forces dipolaires ioniques ou de forces de ponts hydrogène. partie externe de la molécule.
Les colloïdes peuvent avoir une certaine viscosité (la viscosité est la résistance interne d'un fluide : liquide ou gazeux, au mouvement relatif de ses molécules).
Types de colloïdes
Les colloïdes sont classés en fonction de la magnitude de l'attraction entre la phase dispersée et la phase continue ou dispersante.
Si ce dernier est liquide, les systèmes colloïdaux sont classés en "sols" (substrats au sens chimique) et subdivisés en "lyophobes" (peu d'attraction entre la phase dispersée et le milieu dispersant) et les "lyophiles" (grande attraction entre la phase dispersée et le milieu dispersant).
Dans les colloïdes lyophiles, la phase dispersée et le milieu dispersant sont liés, ils forment donc des solutions vraies et ont un caractère thermodynamiquement stable; alors que les colloïdes lyophobes sont ceux où la phase dispersée et le milieu dispersant ne sont pas liés, ils peuvent former deux phases et avoir un caractère cinétiquement stable.
Une caractéristique fondamentale des colloïdes lyophobes est qu'ils ne sont pas thermodynamiquement stables, comme déjà mentionné ci-dessus, bien qu'ils aient une stabilité cinétique qui leur permette de rester dans un état dispersé pendant de longues périodes.
Les particules colloïdales sont suffisamment petites pour que leur comportement soit contrôlé par le mouvement brownien et non par des effets macroscopiques, tels que les forces de gravitation. En ajoutant une certaine quantité d'électrolyte qu'ils peuvent coaguler, la quantité dépend de la valence et de la nature de l'électrolyte.
En ce qui concerne la classification des colloïdes, il convient également de noter que, si le milieu dispersant est de l'eau, ils sont appelés "hydrophobe" (répulsion de l'eau) et "hydrophile" (attraction de l'eau).
En principe, il n'existe pas de règle fixe établissant l'état d'agrégation dans lequel ils se trouvent, à la fois la phase dispersée et le milieu dispersant. Par conséquent, toutes les combinaisons imaginables sont possibles, comme indiqué dans le tableau ci-dessus.
Actuellement, et du fait de ses applications industrielles et biomédicales, l'étude des colloïdes a acquis une grande importance en physico-chimie et en physique appliquée.
Ainsi, de nombreux groupes de recherche du monde entier se consacrent à l'étude des propriétés optiques, acoustiques, de stabilité et de leur comportement vis-à-vis des champs externes. En particulier, le comportement électrocinétique (principalement des mesures de mobilité électrophorétiques) ou la conductivité électrique de la suspension entière.
En général, l'étude des colloïdes est expérimentale, mais des efforts considérables sont également déployés dans les études théoriques, ainsi que dans le développement de simulations informatiques de leur comportement.
Dans la plupart des phénomènes colloïdaux, tels que la conductivité et la mobilité électrophorétique, ces théories ne reproduisent la réalité que qualitativement, mais l'accord quantitatif reste insatisfaisant.
Systèmes colloïdaux
Les principaux systèmes colloïdaux sont :
- Les émulsions : une émulsion est appelée suspension colloïdale d'un liquide dans un autre matériau non miscible avec elle. Elle peut être préparée en agitant un mélange des deux liquides ou en faisant passer l'échantillon dans un broyeur à colloïdes appelé homogénéisateur. Une émulsion est un système où la phase dispersée et la phase continue sont liquides.
- Les substrats lipophobes qui sont relativement instables (ou stables); souvent, une petite quantité d'électrolyte ou une élévation de température suffisent pour provoquer la coagulation et la précipitation des particules dispersées.
- Les aérosols qui sont définis comme des systèmes colloïdaux avec des particules liquides ou solides finalement subdivisées, dispersées dans un gaz. De nos jours, le terme aérosol, en langage général, est synonyme de conteneur métallique à contenu pressurisé, bien qu'on le désigne comme un aérosol atmosphérique.
- Les gels : la formation de gels s'appelle gélification. En général, la transition du soleil au gel est un processus progressif. Bien entendu, la gélification s'accompagne d'une augmentation de la viscosité, qui n'est pas soudaine mais progressive.
- Les mousses : la phase de dispersion peut être liquide ou solide et la phase disperse un gaz.
Propriétés
Les propriétés des colloïdes ou systèmes colloïdaux sont : l'adsorption, l'effet Tyndall, le mouvement brownien, l'électrophorèse et la dialyse.
Les colloïdes présentent un phénomène connu sous le nom d'effet Tyndall observé par Tyndall en 1869. Lorsque nous faisons passer un faisceau de lumière convergent intense à travers une solution colloïdale maintenue dans l'obscurité, le trajet du faisceau est éclairé par une lumière bleuâtre.
Ce phénomène de diffusion de la lumière par les particules colloïdales est appelé effet Tyndall et le trajet lumineux est appelé cône Tyndall. Les particules colloïdales dispersées diffusent la lumière qui tombe sur elles, ce qui entraîne des émissions comparables aux rayonnements ultraviolets et visibles. Ces radiations diffusées s'illuminent.
On observe que la zone de lumière diffusée est beaucoup plus grande que la particule elle-même. Cela fait apparaître les particules colloïdales sous forme de minuscules points brillants lorsqu'ils sont observés au microscope. Cela doit être fait perpendiculairement au faisceau de lumière.
Les vraies solutions ne présentent pas d'effet Tyndall. En effet, la taille des particules (ions ou molécules) présentes dans une vraie solution est trop petite pour diffuser la lumière. Ainsi, l'effet Tyndall peut être utilisé pour distinguer une solution colloïdale d'une vraie solution.
Synonymes, antonymes
Voir tous les synonymes pour "colloïde".1 synonyme (sens proche) de "colloïde" :
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à COLLOÏDE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot COLLOIDE est dans la page 6 des mots en C du lexique du dictionnaire.
Mots en C à proximité
colline collinéen colloblaste collocyte colloïdal colloïdecolluvion côlon colonie colonnaire colonne d'eau
En rapport avec "colloïde"

Colloïdal précise ce qui est de la nature des colloïdes. Les substances colloïdales sont celles qui provoquent le jaunissement de l'eau, surtout en aquarium...
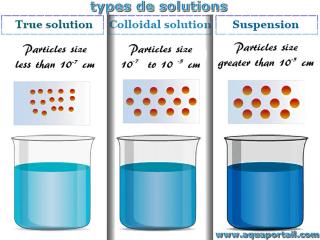
Un état colloïdal correspond à un état de dispersion de la matière au sein d'un liquide, caractérisé par des granules de dimension moyenne, comprise en 0,1...
Le phycocolloïde est un colloïde végétal d'algue, une substance mucilagineuse, gélifiante, extraite des algues, essentiellement des macroalgues.
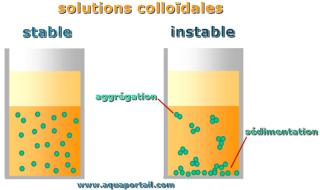
Les colloïdes et leur solution sont connus sous le nom de solution colloïdale. Les solutions colloïdales, ou suspensions colloïdales, ne sont rien d'autre...
