Amine
Définition
Une amine est généralement un groupe fonctionnel (groupe amino) dont l'atome d'azote possède un doublet non liant. Sa structure ressemble à celle de l'ammoniac, où l'azote peut se lier à trois atomes d'hydrogène.
Le groupe amino d'une amine :
Une amine est définie par la présence d'un groupe amino.
Explications
Une amine est un composé organique dérivé de l'ammoniac par remplacement d'un ou plusieurs atomes d'hydrogène par des groupes organiques. Elle se caractérise également par diverses propriétés basées sur la connectivité du carbone.
Les amines constituent une classe fascinante de composés organiques qui jouent un rôle crucial dans divers processus biologiques, industriels et médicinaux. Leur structure unique et leurs propriétés polyvalentes en font un sujet de recherche et d'applications approfondi.
Les amines sont dérivées de l'ammoniac (NH3), dans lequel des groupes alkyle ou aryle remplacent un ou plusieurs atomes d'hydrogène. Elles se caractérisent par la présence d'un atome d'azote lié à des atomes de carbone et d'hydrogène. La formule générale d'une amine est RNH2, où R représente le groupe alkyle ou aryle.
L'une des propriétés les plus distinctives des amines est leur odeur piquante. Cette odeur est particulièrement prononcée chez les amines de faible poids moléculaire, souvent décrites comme ayant une odeur de poisson ou d'ammoniaque. Cependant, à mesure que la taille et la complexité des molécules d'amine augmentent, leur odeur tend à s'estomper.
La structure des amines s'articule autour de l'atome d'azote central lié à divers substituants. Selon le nombre d'atomes d'hydrogène remplacés par des groupes alkyle ou aryle, les amines peuvent être classées en plusieurs types.
Les groupes aminos (amines) :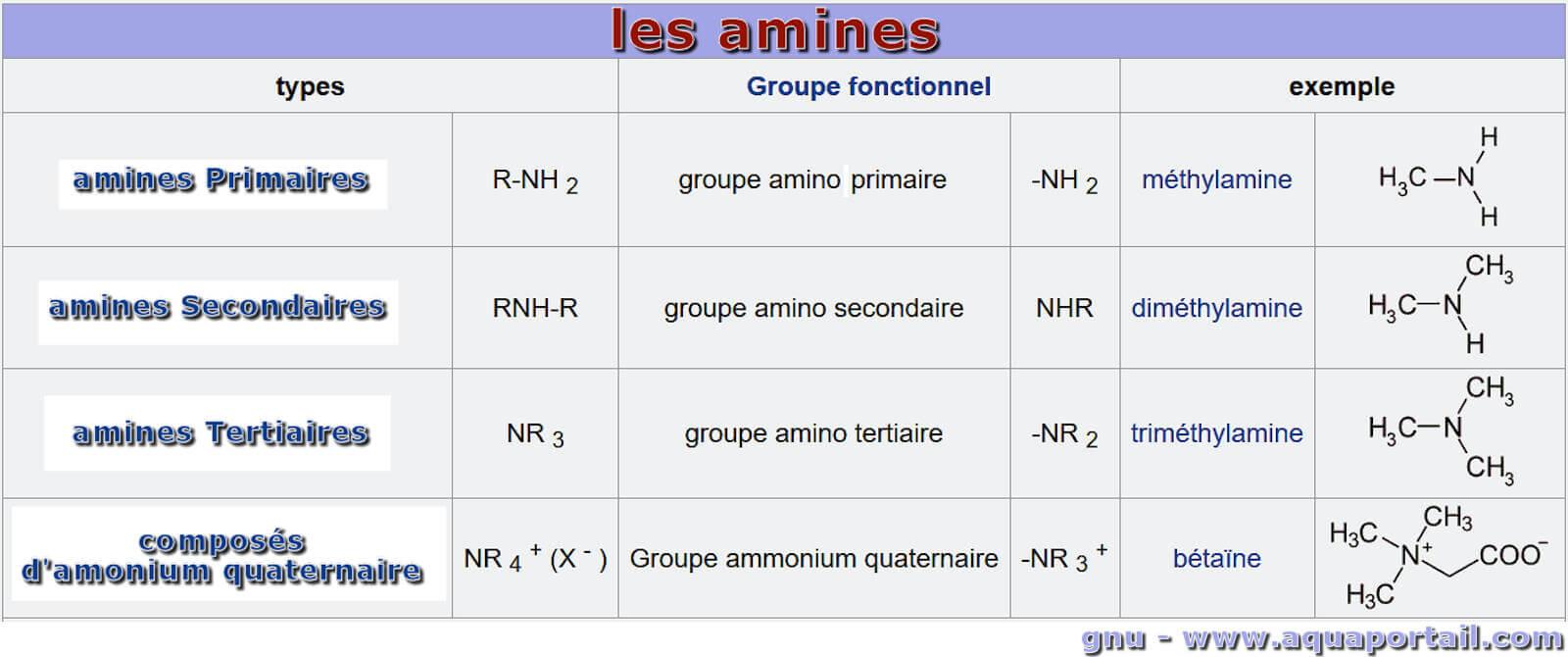
Les amines et les groupes amino sont classés en fonction du nombre d'atomes d'hydrogène de l'ammoniac échangés contre des groupes moléculaires organiques.
lire plus de détails pour une amine (groupe amino)...
Synonymes, antonymes
Voir tous les synonymes pour "amine".2 synonymes (sens proche) de "amine" :
- amino
- groupe amino
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à AMINE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot AMINE est dans la page 5 des mots en A du lexique du dictionnaire.
Mots en A à proximité
amide amidon amidon floridéen amidon intraplastidial amination amineamine biogène aminoacide aminoacyl-adénylate aminoacylation aminoglycoside
En rapport avec "amine"
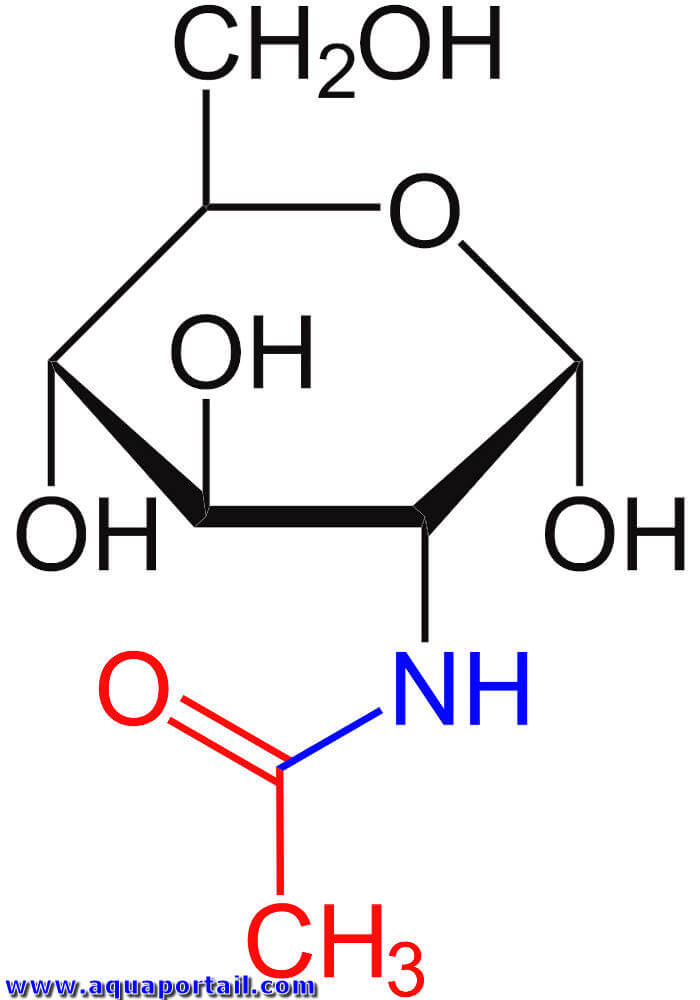
L'acétylglucosamine est un composé de sucre, d'un groupe amine et d'un groupe acétyle, proche de la cellulose.

Les amines biogènes (monoamines) sont des amines primaires qui apparaissent dans le métabolisme (de micro-organismes, de plantes, d'animaux et d'humains)...

L'ammoniac est un gaz incolore composé de 82 % d'azote (N) et de 18 % d'hydrogène (H) dont la formule chimique est NH₃.

Le groupe fonctionnel est une partie structurelle d'une molécule caractérisée par des éléments spécifiques et une organisation précise bien définie.
