Énergie d'ionisation
Définition
L'énergie d'ionisation est une mesure de la quantité d'énergie nécessaire pour éliminer un électron externe d'un atome créant un ion chargé positivement. Le processus d'ionisation survient lorsqu'un électron est retiré de l'enveloppe externe d'un atome. Le processus déclenche un potentiel d'ionisation.
L'énergie d'ionisation sur un tableau périodique :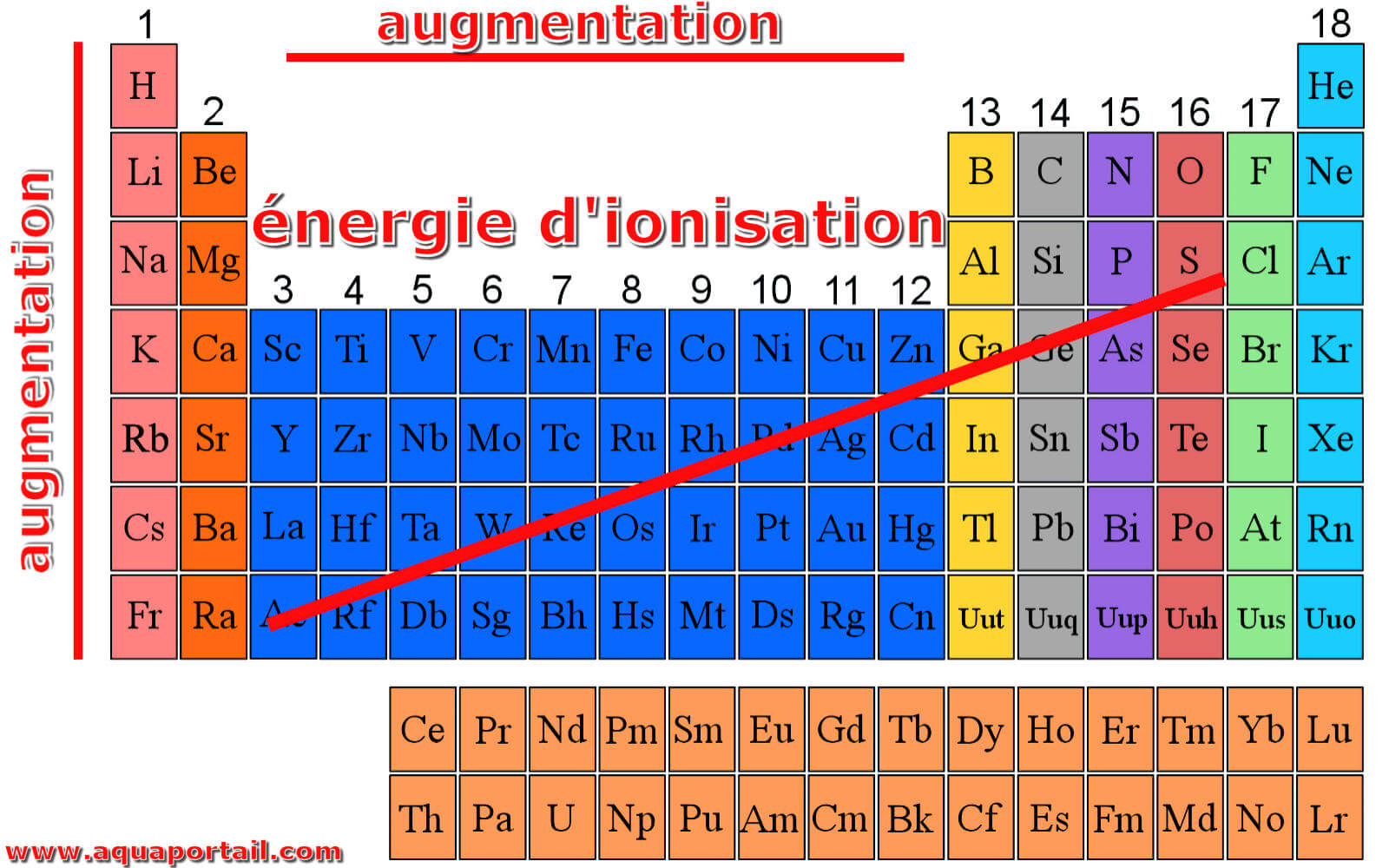
Énergie d'ionisation de chaque élément d'une table périodique. Par exemple, les métaux alcalins du groupe 1 nécessitent plus d'énergie pour retirer un électron de sa couche externe. La progression vers le bas du groupe entraîne une diminution de l'énergie d'ionisation car il y a plus d'électrons réduisant la charge nucléaire.
Explications
L'ionisation conduit à la formation d'un ion positif. L'énergie d'ionisation est la quantité d'énergie nécessaire pour éliminer l'électron de valence le plus externe d'un atome conduisant à la formation d'un ion positif et d'un électron non lié.
En général, plus l'atome est petit et moins il y a de couches d'électrons, plus l'énergie d'ionisation sera élevée. Cela conduit au schéma général dans le tableau périodique selon lequel l'énergie d'ionisation diminue vers le bas des groupes car il y a plus de couches électroniques qui réduisent la charge nucléaire et son efficacité, cela se traduit par moins d'énergie nécessaire pour éliminer l'électron externe.
Cependant, au cours d'une période, l'énergie d'ionisation augmente. En effet, il y a l'ajout d'un proton à chaque fois, ce qui entraîne une charge nucléaire plus élevée en raison de la charge positive des protons et il n'y a pas d'ajout de plusieurs coquilles, ils ont le même nombre de coquilles sur une période. Si nous prenons l'exemple du lithium, l'énergie d'ionisation est bien inférieure à celle du fluor sur la période 2.
En effet, le lithium a moins de protons dans le noyau, ce qui signifie qu'il a une charge nucléaire inférieure à celle du fluor. Le lithium a 3 protons dans son noyau alors que le fluor en a 9, il a donc une charge nucléaire beaucoup plus grande et une attraction pour l'électron externe. Cela signifie qu'il faut plus d'énergie pour éliminer l'électron externe.
Première et deuxième énergie d'ionisation
La première énergie d'ionisation des atomes est l'énergie nécessaire pour éliminer une mole d'électrons d'une mole d'atomes afin de créer une mole d'ions positifs. C'est l'énergie nécessaire pour éliminer les électrons pour créer un ion positif. En général, la deuxième énergie d'ionisation est plus élevée sur tous les éléments, car la suppression d'un électron fait qu'un atome devient positif, ce qui signifie que la charge nucléaire augmente, rapprochant les électrons d'eux.
Synonymes, antonymes
Voir tous les synonymes pour "énergie d'ionisation".1 synonyme (sens proche) de "energie d'ionisation" :
- potentiel d'ionisation
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à ÉNERGIE D'IONISATION sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
L'expression ENERGIE D'IONISATION est dans la page 3 des mots en E du lexique du dictionnaire.
Mots en E à proximité
ènediolate énergideénergie alimentaire énergie brute énergie cinétique énergie d'ionisationénergie digestible énergie libre énergie métabolisable énergie nette énergie propre
En rapport avec "énergie d'ionisation"

L'échelle de Pauling est une méthode largement utilisée pour ordonner les éléments chimiques selon leur électronégativité.

L'électronégativité est une mesure de la capacité d'un atome à attirer des électrons vers lui dans une liaison covalente.
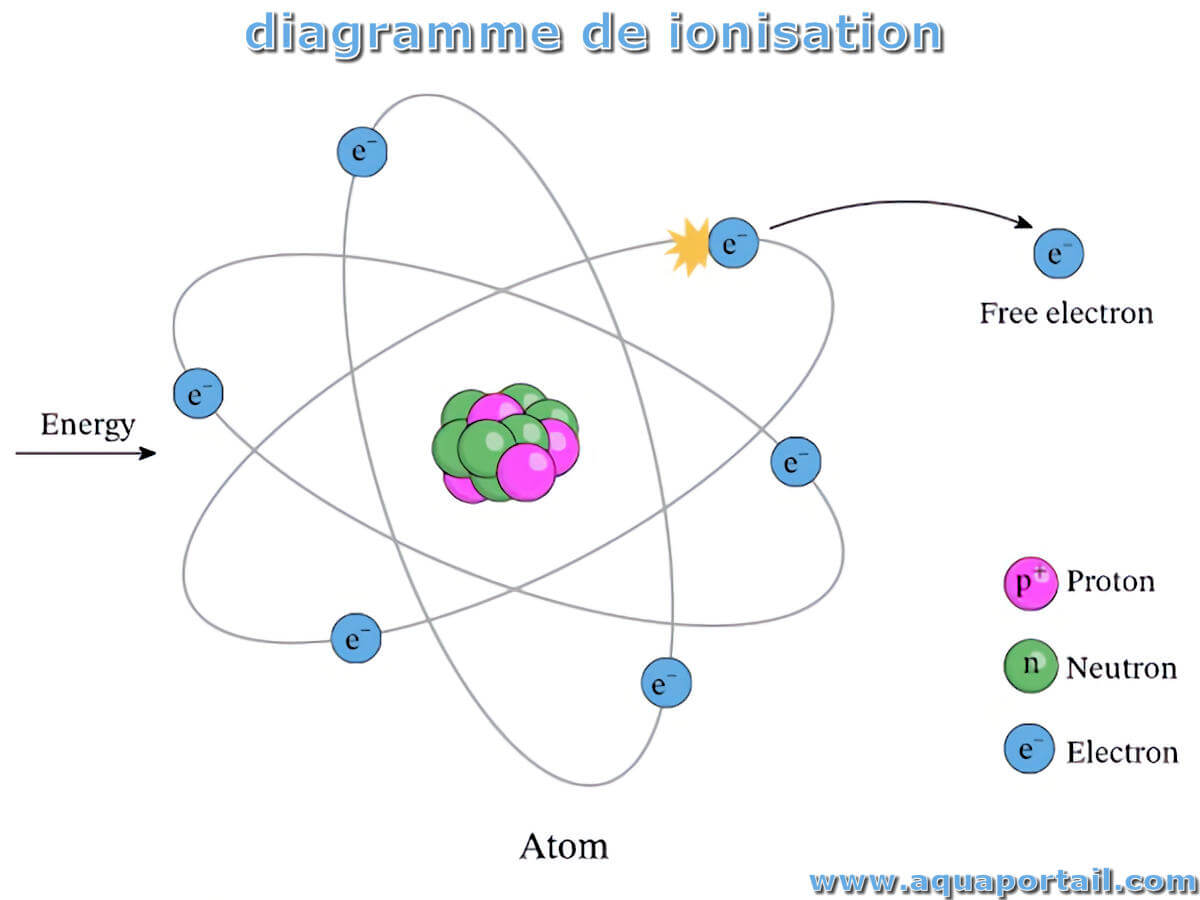
Une ionisation est une décomposition (ou dissociation) d'une molécule en ions. C'est le phénomène chimique ou physique par lequel sont produits des ions...

La bioénergie est une énergie d'origine biologique produite au sein des biotes, des êtres vivants.
