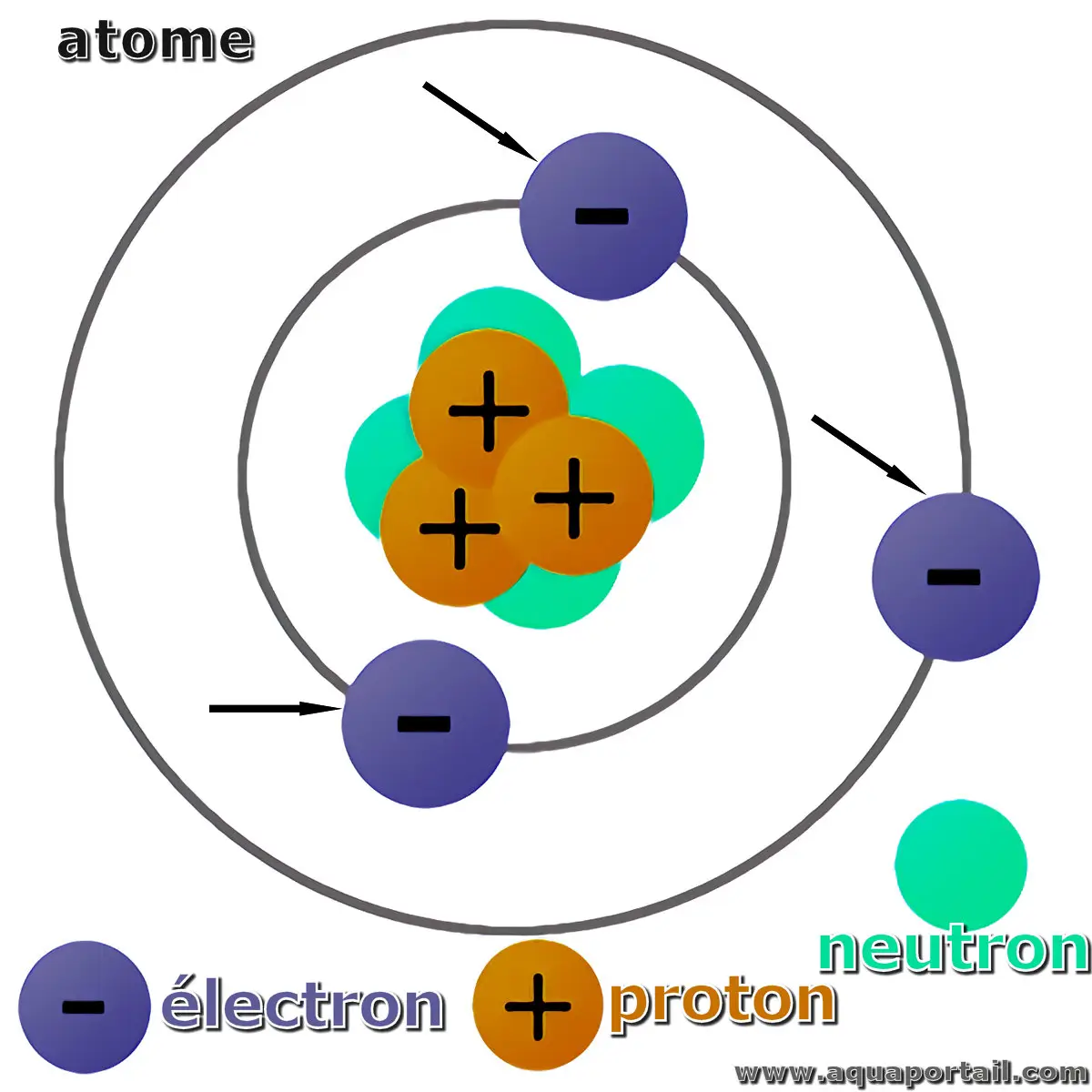
Un atome
L'atome est une unité fondamentale de la matière, la plus petite unité indivisible d'une substance chimique, constituée d'un noyau central de charge électrique positive enveloppé par un nuage d'électrons chargés négativement. Le noyau atomique est composé de protons et de neutrons.
Un atome :
L'atome présente un noyau central entouré d'électrons. Les électrons sont connectés au noyau par une force électromagnétique.
Généralités
Un atome qualifie le constituant ultime de la matière, formé d'un noyau, une particule lourde possédant une charge électrique positive, et d'un ou plusieurs électrons, des particules légères possédant une charge électrique négative équilibrant celle du noyau. Un assemblage d'atome crée une molécule.
Un atome est la plus petite particule permettant de diviser un élément sans perdre son identité chimique. Pendant des années, les scientifiques ont cru que l'atome était la plus petite chose qui soit. Puis ils ont scindé l'atome et découvert les électrons. Après l'invention de l'accélérateur de particules, ils ont décomposé l'atome en autant de petits fragments que possible. Ces petits fragments sont appelés quarks.
L'atome est une particule élémentaire (comme l'hydrogène, le carbone, l'oxygène, l'azote, le fer, le plomb, etc.) constituant les molécules organiques ou inorganiques. Un assemblage de molécules crée un composé ou une substance. Si les deux atomes (ou plus) formant une molécule sont tous identiques, c'est une molécule élémentaire diatomique (ou polyatomique).
Un groupe d'atomes peut être relié entre eux par des liaisons chimiques basées sur la même force, formant une molécule. Un atome ayant le même nombre de protons et d'électrons est électriquement neutre, tandis qu'un atome ayant un nombre différent peut avoir une charge positive ou négative, et est donc appelé un ion.
Les atomes sont classés en fonction du nombre de protons au niveau de leur noyau : le nombre de protons détermine l'élément chimique et le nombre de neutrons détermine l'isotope de cet élément.
Les atomes sont des objets minuscules dont le diamètre n'est que de quelques dixièmes de nanomètres et dont la masse est faible par rapport à leur volume. Leur observation n'est possible qu'en utilisant des instruments appropriés, tels que le microscope à courant tunnel. Environ 99,94 % de la masse atomique est concentrée dans le noyau, les protons et les neutrons ayant approximativement la même masse.
Chaque élément possède au moins un isotope de nucléide instable pouvant subir une décroissance radioactive. Cela peut entraîner l'apparition d'une transmutation qui modifie le nombre de protons ou de neutrons dans le noyau.
Les électrons connectés aux atomes ont un ensemble stable de niveaux d'énergie, ou orbitales atomiques, et peuvent subir des transitions entre eux en absorbant ou en émettant des photons qui correspondent à la différence d'énergie entre ces niveaux.
Les électrons définissent les propriétés chimiques d'un élément et influencent les propriétés magnétiques d'un atome. La mécanique quantique est la théorie qui décrit correctement la structure et les propriétés des atomes.
Exemple avec un atome d'hélium :
un atome d'hélium, dans lequel est représenté le noyau (rosacé) et la distribution du nuage d'électrons (noir). Le noyau (coin supérieur droit) de l'hélium-4 est symétrique et ressemble étroitement au nuage d'électrons, bien que cela n'existe pas toujours dans les noyaux plus complexes. L'échelle graphique correspond à un ångström (10-10 m ou 100 pm).
Particules subatomiques
Bien que la signification originale du terme atome corresponde à une particule qui ne peut pas être divisée en particules plus petites, dans le contexte scientifique contemporain, l'atome est constitué de plusieurs particules subatomiques : l'électron, le proton et le neutron.
Cependant, il existe des exceptions : un atome d'hydrogène-1 (isotope stable) n'a pas de neutrons et un ion hydrogène n'a pas d'électrons.
L'électron est la plus petite particule avec seulement 9,11 × 10-31 kg, ayant une charge électrique négative et une dimension tellement réduite qu'il n'est pas possible de la mesurer avec la technologie actuelle.
Le proton a une charge positive et une masse supérieure de 1836 fois à celle des électrons - 1,6726 × 10-27 kg.
Le neutron n'a pas de charge électrique et a une masse 1839 fois supérieure à la masse de l'électron, soit 1,6929 × 10-27 kg.
Le neutron et le proton ont des dimensions comparables, de l'ordre de 2,5 × 10-15 m, bien que la surface de ces particules n'ait pas de contours précis.
Dans le modèle standard de la physique des particules, les électrons sont vraiment des particules élémentaires sans structure interne. Cependant, les protons et les neutrons sont des particules composites, formées par des particules appelées quarks.
Les protons sont constitués de deux quarks up (chacun avec une charge de +2/3) et un quarks down (avec charge -1/3).
Les neutrons se composent d'un quark up et de deux quarks down. Cette différence est responsable des différentes valeurs de masse et de charge entre les deux particules.
Les quarks sont maintenus ensemble par la force forte, médiée par les gluons. D'autre part, les protons et les neutrons se maintiennent ensemble par la force nucléaire, un résidu de force forte avec des propriétés différentes. Le gluon est un membre de la famille des bosons de calibre, qui sont des particules élémentaires qui médient les forces physiques.
Noyau atomique
L'ensemble des protons et des neutrons connectés ensemble dans un atome forme un petit noyau atomique. Ces éléments formant le noyau sont collectivement appelés des nucléons.
Le rayon d'un noyau est approximativement égal à 1,07 × 10-3(A) fm (≈ 10-15 m), où A est le nombre total de nucléons. Cette valeur est très inférieure au rayon de l'atome lui-même, qui est de l'ordre de 105 fm.
Les nucléons restent liés ensemble par un potentiel attractif à courte portée appelé la force nucléaire résiduelle. À des distances inférieures à 2,5 fm, cette force est beaucoup plus puissante que la force électrostatique, ce qui fait que les protons chargés positivement se repoussent.
Les atomes d'un même élément chimique ont toujours le même nombre de protons, ce qui s'appelle le nombre atomique. Entre chaque élément, le nombre de neutrons peut varier, déterminant ainsi l'isotope de cet élément.
Le nombre total de protons et de neutrons détermine le nucléide. Le nombre de protons par rapport au nombre de neutrons détermine la stabilité du noyau, certains isotopes étant radioactifs.
Les neutrons et les protons sont différents types de fermions. Le principe d'exclusion de Pauli est un principe de mécanique quantique qui interdit à des fermions identiques, tels que des protons multiples, d'occuper le même état physique quantique en même temps.
Par conséquent, tous les protons du noyau doivent occuper un état différent, avec leur propre niveau d'énergie, appliquant la même règle à tous les neutrons. Cette interdiction ne s'applique pas à un proton et un neutron qui occupent le même état quantique.
Dans les atomes de faible nombre atomique, un noyau ayant un nombre de protons autre que le nombre de neutrons peut se désintégrer à un état d'énergie inférieur par radioactivité, de sorte que le nombre de protons et d'électrons est égalisé. Pour cette raison, les atomes ayant un nombre similaire de protons et de neutrons sont plus stables en ce qui concerne la radioactivité.
Cependant, à mesure que le nombre atomique augmente, la répulsion mutuelle entre les protons nécessite une proportion croissante de neutrons pour maintenir la stabilité du noyau. Ainsi, il n'y a pas de noyaux stables ayant le même nombre de protons et de neutrons au-dessus du nombre atomique 20 (calcium), et lorsque la valeur augmente, le rapport proton-neutron requis pour la stabilité augmente à environ 1,5.
Le nombre de protons et de neutrons dans le noyau atomique peut être modifié, bien que de grandes quantités d'énergie puissent être nécessaires pour surmonter la force forte. La fusion nucléaire survient lorsque plusieurs particules atomiques se réunissent pour former un noyau plus lourd, comme dans le cas d'une collision entre deux noyaux.
Par exemple, dans le soleil, les protons ont besoin d'énergie de l'ordre de 3 à 10 keV pour surmonter leur répulsion mutuelle - la barrière de Coulomb - et fusionner en un seul noyau.
La fission nucléaire est le processus inverse, dans lequel le noyau se divise en deux noyaux plus petits, habituellement par la radioactivité. Le noyau peut également être modifié par bombardement avec des particules subatomiques de haute énergie ou des photons. Si cela change le nombre de protons dans le noyau, l'atome change en un élément chimique différent.
Si, après une réaction de fusion, la masse d'un noyau est inférieure à la somme des masses des différentes particules, la différence entre ces deux valeurs peut être émise par l'énergie utile (comme les rayons gamma ou l'énergie cinétique d'une particule bêta) comme décrit dans la formule d'équivalence masse-énergie Einstein E=mc2, où m est la perte de masse et c est la vitesse de la lumière.
Ce déficit fait partie de l'énergie de liaison du nouveau noyau, la perte irrécupérable d'énergie qui provoque le collage des particules en fusion.
La fusion de deux noyaux qui donnent naissance à des noyaux plus grands avec des nombres atomiques plus faibles que le fer et le nickel (60) est généralement une réaction exothermique qui libère plus d'énergie que nécessaire pour les faire fondre.
C'est ce processus de libération d'énergie qui fait de la fusion nucléaire-étoile une réaction auto-entretenue.
Dans les noyaux plus lourds, l'énergie de liaison par nucléon dans le noyau commence à diminuer. Cela signifie que les processus de fusion qui produisent des noyaux avec un nombre atomique supérieur à 26 et une masse atomique supérieure à 60 sont endergoniques, des réactions endergoniques.
Ces noyaux de masse plus grande ne sont pas capables de donner lieu à une réaction de fusion produisant de l'énergie qui supporte l'équilibre hydrostatique d'une étoile.
Nuage d'électrons
Les électrons d'un atome sont attirés par les protons du noyau au moyen de la force électromagnétique. Cette force maintient les électrons à l'intérieur d'un puits de potentiel électrostatique autour du noyau plus petit, ce qui signifie qu'une source d'énergie externe est nécessaire pour que l'électron puisse s'échapper.
Plus l'électron est proche du noyau, plus la force d'attraction est grande. Ainsi, les électrons qui sont connectés plus près du centre du puits de potentiel nécessitent plus d'énergie pour s'échapper que ceux à la périphérie.
Les électrons, comme les autres particules, possèdent à la fois des propriétés de particules et d'ondes. Le nuage d'électrons est une région à l'intérieur du puits de potentiel dans lequel chaque électron forme une forme d'onde stationnaire tridimensionnelle - une onde qui ne bouge pas par rapport au noyau.
Ce comportement est défini par une orbitale atomique, une fonction mathématique qui caractérise la probabilité qu'un électron apparaisse à un certain endroit lorsque sa position est mesurée.
Il y a seulement un nombre limité d'orbitales autour du noyau, puisque d'autres modèles d'onde possibles se désintègrent rapidement dans des formes plus stables.
Les orbitales peuvent avoir un ou plusieurs anneaux ou noeuds, et différer en termes de taille, de forme et de direction.
Chaque orbitale atomique correspond à un certain niveau d'énergie d'un électron. Un électron peut changer son état à un niveau d'énergie plus élevé en absorbant un photon avec suffisamment d'énergie pour le propulser dans le nouvel état quantique.
De même, par l'émission spontanée, un électron qui est dans un état d'énergie supérieur peut descendre à un état inférieur en émettant de l'énergie excédentaire à travers des photons.
Ces valeurs d'énergie caractéristiques, définies par les différences d'énergie dans les états quantiques, sont responsables des raies spectrales atomiques.
La quantité d'énergie nécessaire pour éliminer ou ajouter un électron (l'énergie de liaison électronique) est beaucoup plus faible que l'énergie de liaison du nucléon. Par exemple, seulement 13,6 eV est nécessaire pour enlever un électron d'un atome d'hydrogène qui est au niveau fondamental, comparé à 2,23 millions d'eV pour diviser un noyau de deutérium.
Les atomes sont électriquement neutres lorsqu'ils ont un nombre égal de protons et d'électrons. Les atomes qui ont un déficit ou un excès d'électrons sont appelés des ions. Les électrons les plus éloignés du noyau peuvent être transférés à d'autres atomes ou partagés entre les atomes.
Grâce à ce mécanisme, les atomes sont capables de se lier dans des molécules ou d'autres types de composés chimiques sous forme de cristaux ioniques ou covalents.
En rapport avec "atome"

En physique atomique, une couche électronique, en rapport avec le niveau énergétique d'un atome, peut être considérée comme l'ensemble des orbites suivies...
L'électron (e⁻) est une particule élémentaire chargée négativement. Les électrons liés par un atome ou un ion forment sa couche d'électrons.

Un neutron est une particule subatomique d'environ la même masse atomique qu'un proton mais sans charge électrique.

Un proton est une particule subatomique avec une charge électrique élémentaire positive, égale en valeur absolue et en signe opposé à celle de l'électron.
