Électrolyse
Définition
Une électrolyse est une décomposition chimique de certaines substances en fusion ou en solution par le passage d'électricité. L'électrolyse est une réaction chimique dans laquelle les substances composées sont décomposées en substances simples et/ou d'autres substances composites sous l'influence d'un courant électrique.
Voir aussi l'électrolyse de l'eau.
Diagramme simplifié du processus d'électrolyse :
L'électrolyse est le processus qui sépare les éléments d'un composé chimique au moyen de l'électricité. Une capture d'électrons par les cations dans la cathode (une réduction) intervient avec la libération d'électrons par les anions dans l'anode (une oxydation).
Processus
Le processus d'une électrolyse passe par plusieurs étapes :
- Un courant électrique continu est appliqué par une paire d'électrodes connectées à une source d'alimentation et immergées dans la solution. L'électrode connectée au pôle positif est connue comme l'anode, et celle connectée au négatif comme une cathode.
- Chaque électrode attire les ions de charge opposés. Ainsi, les ions négatifs, ou anions, sont attirés et se dirigent vers l'anode (électrode positive), tandis que les ions positifs, ou cations, sont attirés et se dirigent vers la cathode (électrode négative).
- La façon la plus simple de se souvenir de toute cette terminologie est de regarder la racine grecque des mots. Odos signifie route. L'électrode est le chemin par lequel les électrons vont. Catha signifie vers le bas (catacombe, catastrophe). La cathode est le chemin par lequel les électrons tombent. Anas signifie haut. L'anode est le chemin par lequel les électrons montent. Ion signifie un marcheur. L'anion va à l'anode et le cation va à la cathode. La nomenclature est également utilisée dans les batteries. Un moyen facile de se souvenir également de la terminologie est de prendre en compte la première lettre de chaque électrode et de l'associer au processus qui s'y produit; c'est-à-dire que l'oxydation existe à l'anode (les deux mots commencent par les voyelles) et à la cathode la réduction (les deux mots commencent par les consonnes).
- L'énergie nécessaire pour séparer les ions et augmenter leur concentration dans les électrodes est fournie par l'alimentation électrique.
- Dans les électrodes, il y a un transfert d'électrons entre ceux-ci et les ions, produisant de nouvelles substances. Des ions négatifs ou des anions donnent des électrons à l'anode (+) et des ions positifs ou des cations prélèvent des électrons de la cathode (-).
En bref, ce qui se passe avec l'électrolyse est une réaction d'oxydo-réduction, où la source d'énergie électrique est responsable de fournir l'énergie nécessaire.
Applications de l'électrolyse
Sans être exhaustif, l'électrolyse a de nombreuses applications industrielles :
- Production d'aluminium, de lithium, de sodium, de potassium et de magnésium.
- Production d'hydroxyde de sodium, d'acide chlorhydrique, de chlorate de sodium et de chlorate de potassium.
- Production d'hydrogène à usages multiples dans l'industrie : comme combustible, en soudage, etc. Voir plus dans l'hydrogène diatomique.
- L'électrolyse d'une solution saline permet la production d'hypochlorite (chlore) : cette méthode permet d'obtenir une chloration écologique de l'eau de piscine.
- L'électrométallurgie est un procédé permettant de séparer le métal pur des composés en utilisant l'électrolyse. Par exemple, l'hydroxyde de sodium est séparé en sodium pur, oxygène pur et hydrogène pur.
- L'anodisation est utilisée pour protéger les métaux contre la corrosion.
- La galvanoplastie, également utilisée pour empêcher la corrosion des métaux, crée un film mince d'un métal moins corrosif sur un autre penco.
Histoire
L'électrolyse a été accidentellement découverte en 1 800 par William Nicholson alors qu'il étudiait le fonctionnement des batteries. En 1834, le physicien et chimiste anglais Michael Faraday développa et publia les lois de l'électrolyse qui portent son nom. Plus tard, cette découverte est devenue connue comme la première loi d'électrolyse de Faraday.
Après cela, Faraday a également découvert que la masse des éléments formés était directement proportionnelle à la masse atomique des éléments impliqués. Cela a renforcé la suspicion de l'existence d'électrons. Cette découverte est devenue connue comme la deuxième loi d'électrolyse de Faraday.
Synonymes, antonymes
Voir tous les synonymes pour "électrolyse".0 synonyme (sens proche) pour "electrolyse".
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à ÉLECTROLYSE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot ELECTROLYSE est dans la page 2 des mots en E du lexique du dictionnaire.
Mots en E à proximité
électroblaste électrocyte électrode électrogèneélectrolocation électrolyseélectrolyse de l'eau électrolyte électromagnétisme électromètre électrométrie
En rapport avec "électrolyse"
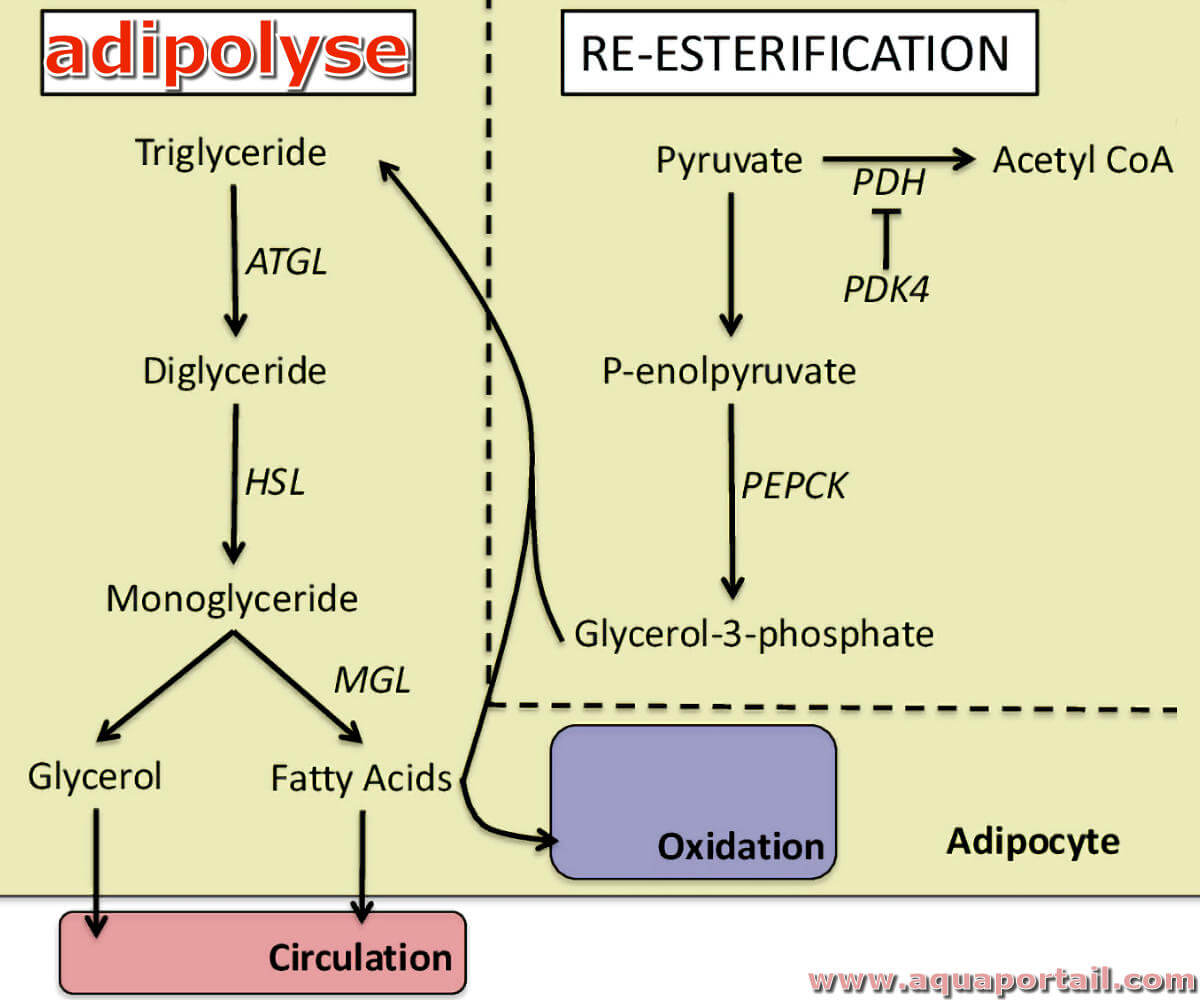
Une adipolyse, par opposition à l'adipogenèse, qualifie l'hydrolyse du tissu adipeux, la destruction d'une substance adipeuse composée d'adipocytes.
L'autolyse est un processus par lequel une cellule s'autodétruit. L'autolyse est une destruction (lyse autogène) de cellules ou de tissus par leurs propres...
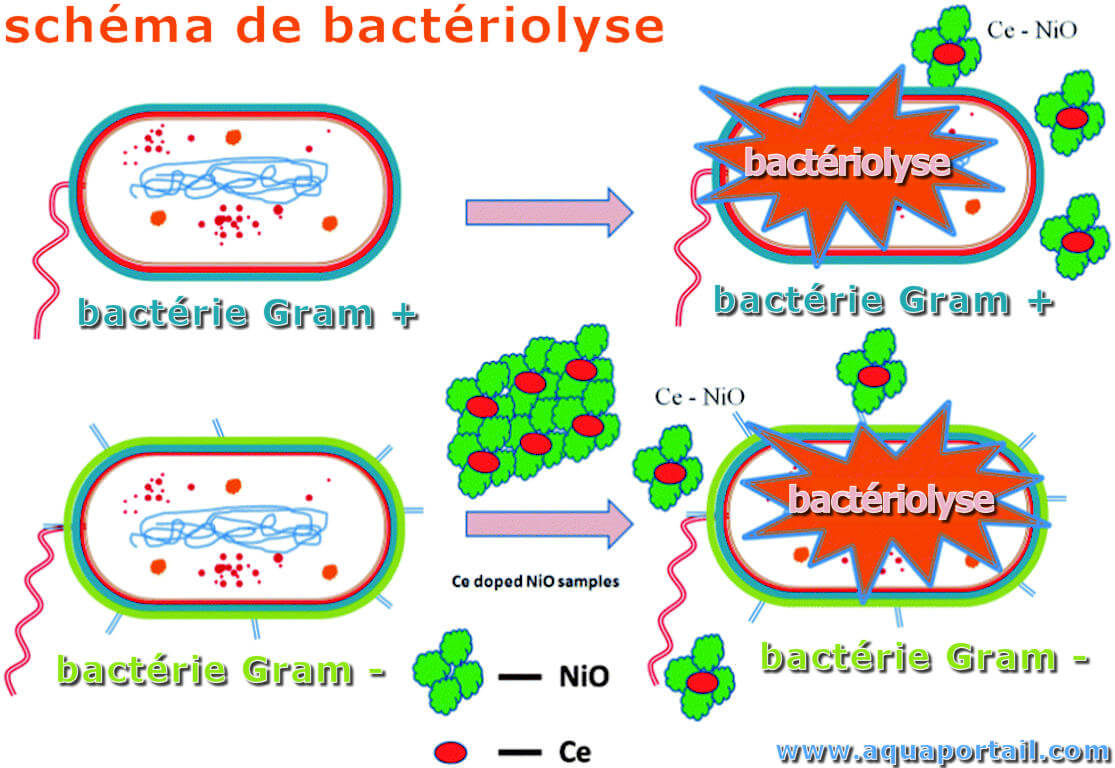
La bactériolyse est une lyse cellulaire de bactérie. Elle consiste en la destruction de bactéries par certaines substances bactériolytiques.

La biocatalyse est le processus chimique par lequel des enzymes ou d'autres catalyseurs biologiques effectuent des réactions entre des composants organiques.
