Polyimide
Définition
Le polyimide est un polymère de monomères imide contenant deux groupes acyle liés à l'azote. Il peut être aussi bien thermodurcissable que thermoplastique. Il remplace des matériaux comme le verre, les métaux et même l'acier dans certaines applications.
Les polyimides sont constitués de dianhydrides aromatiques et de monomères diamines et appartiennent à la classe des matériaux des plastiques techniques à hautes performances.
La réaction de formation d'un polyimide :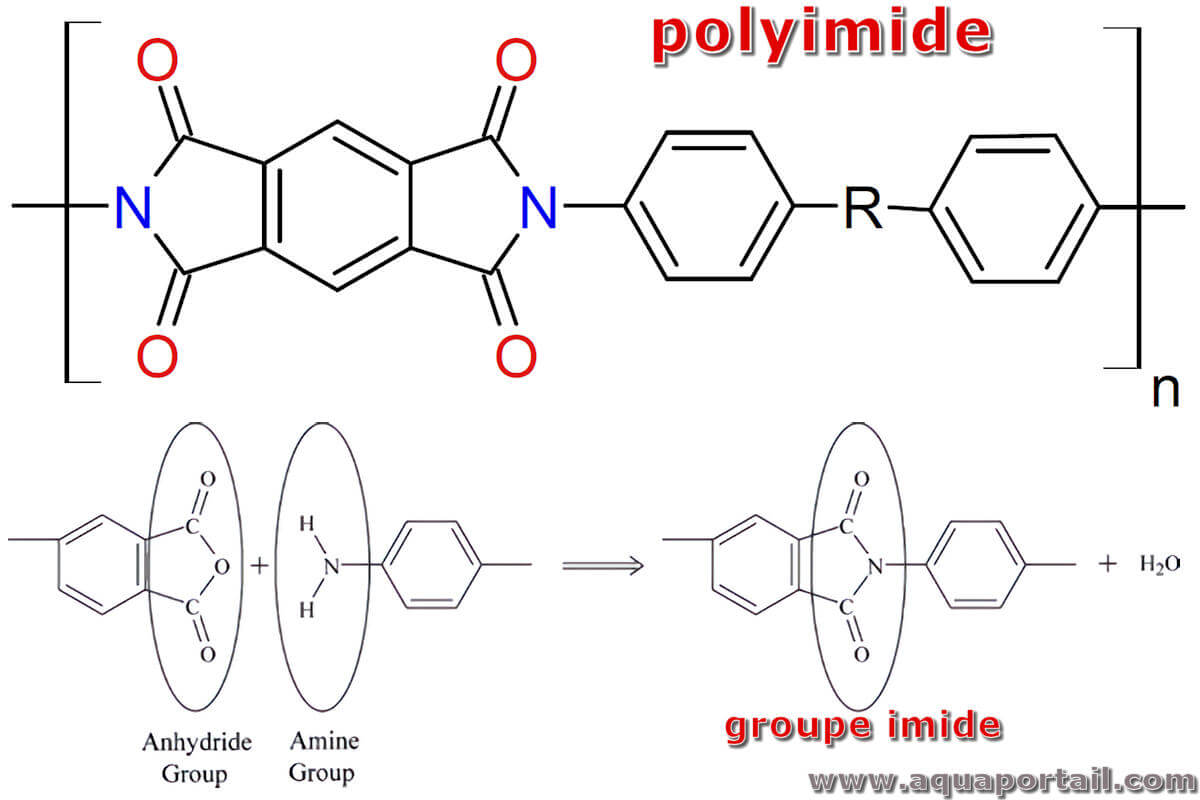
En haut : structure générale d'un polyimide. En bas : réaction d'une amine avec un anhydride pour former un imide.
Explications
Les polyimides sont des polymères thermoplastiques de haute performance. Semblables au polyéthylène, les polyimides ont une teneur élevée en hydrogène et se sont révélés prometteurs pour une utilisation future dans les applications de protection contre les neutrons. Les polyimides peuvent être transformés en films et en résines matricielles, ce qui facilite la fabrication, tout en offrant des propriétés mécaniques et thermiques supérieures par rapport au polyéthylène pur.
Malgré ces avantages, il est toujours nécessaire de combiner des polyimides avec d'autres matériaux afin de produire un matériau multifonctionnel qui pourrait répondre aux exigences de résistance pour des applications structurellement importantes. Il existe cependant un inconvénient substantiel à l'utilisation de polyimides pour des applications de protection contre les rayonnements.
Les polyimides (PI) sont des polymères techniques à haute température développés à l'origine par la société DuPont. Les PI présentent une combinaison exceptionnelle de stabilité thermique (> 500 °C), de ténacité mécanique et de résistance chimique. Ils ont d'excellentes propriétés diélectriques et un coefficient de dilatation thermique intrinsèquement faible. Ils sont formés de diamines ou de diisocyanates et de dianhydrides.
Structure
Un polyimide est un polymère qui contient un groupe imide. Les polyimides peuvent prendre l'une des deux formes. La première de ces structures est une structure linéaire où les atomes du groupe imide font partie d'une chaîne linéaire. La seconde est une structure hétérocyclique où le groupe imide fait partie d'une unité cyclique dans la chaîne polymère.
La structure cyclique est énormément plus stable à la chaleur et aux environnements corrosifs. C'est souvent le cas, qu'une forme cyclique d'un groupe fonctionnel est plus stable que son analogue linéaire.
Les polyimides hétérocycliques aromatiques sont typiques de la plupart des polyimides commerciaux. Ces polymères ont des propriétés mécaniques et thermiques tellement incroyables qu'ils ont remplacé certains métaux et verres dans des applications hautes performances dans les secteurs de l'électronique, de l'automobile et même de l'aérospatiale.
Ces propriétés proviennent de fortes forces intermoléculaires entre les chaînes de polymères et de la rigidité des segments aromatiques dans les unités répétitives de ces polymères. Ces forces impliquent des interactions polaires, l'empilement aromatique et le plus important ici, la complexation par transfert de charge.
Un polymère qui contient un complexe de transfert de charge est constitué de deux types de segments différents, un donneur et un accepteur. Le donneur est comme un homme riche qui a plus d'argent qu'il ne sait quoi en faire et qui veut en donner. Il a beaucoup d'électrons à parcourir à cause (dans ce cas) de ses groupes azotés. Ses groupes carbonyle, comme les nombreux vices de notre invité, aspirent la densité électronique. Cela ne dérange pas le donneur de soutenir l'accepteur, et en fait, avec l'accepteur autour, le donneur a meilleure apparence. Ainsi, le donneur prête certains de ses électrons à l'accepteur, qui maintient alors les deux segments étroitement ensemble.
Le complexe de transfert de charge fonctionne non seulement entre les unités adjacentes dans la chaîne polymère, mais également entre les chaînes. Les chaînes s'empileront comme des bandes de papier, les donneurs et les accepteurs étant jumelés et resserrant les chaînes plus étroitement. L'empilement serré est rendu possible par la planéité des segments aromatiques, même ceux auxquels sont attachés les groupes imide.
Ce complexe de transfert de charge maintient les chaînes si étroitement qu'elles ne peuvent pas beaucoup bouger. Lorsque les choses ne peuvent pas se déplacer au niveau moléculaire, elles ne peuvent pas se déplacer dans l'ensemble du matériau. C'est pourquoi les polyimides sont si solides. C'est aussi pourquoi ils ne fondent ou ne ramollissent pas, sauf à des températures très élevées.
Bien sûr, vous pouvez avoir trop d'une bonne chose. Les interactions sont si fortes qu'elles rendent le matériau difficile à traiter ou à utiliser. Il peut donc devenir nécessaire de rendre le polymère un peu plus mou pour qu'il puisse être transformé en quelque chose d'utile. Ceci est accompli au niveau moléculaire en utilisant des monomères qui ont des segments plus flexibles.
Les interactions sont si fortes qu'elles rendent le matériau difficile à traiter ou à utiliser. Il peut donc devenir nécessaire de rendre le polymère un peu plus mou pour qu'il puisse être transformé en quelque chose d'utile. Ceci est accompli au niveau moléculaire en utilisant des monomères qui ont des segments plus flexibles. L'un d'entre eux est la liaison dérivée du bisphénol-A.
Une autre propriété intéressante des polyimides qui les rend excellents pour une utilisation dans certaines industries de la construction et du transport est la façon dont ils brûlent, ou plutôt ne brûlent pas.
Utilisations
Les polyimides sont des polymères synthétiques incroyablement solides qui sont également incroyablement résistants à la chaleur et aux produits chimiques. Leurs propriétés sont si grandes que ces matériaux remplacent souvent le verre et l'acier dans de nombreuses applications industrielles exigeantes. Ils peuvent être utilisés pour les entretoises et le châssis de certaines voitures ainsi que pour certaines pièces sous le capot, car ils peuvent résister à la chaleur intense et aux lubrifiants, carburants et liquides de refroidissement corrosifs dont les voitures ont besoin.
Les polyimides sont même utilisés dans de nombreuses applications quotidiennes. Qui sait, vous en avez peut-être même quelques-uns chez vous. Avez-vous des polyimides dans votre cuisine ? Ils sont utilisés dans de nombreuses applications quotidiennes telles que les ustensiles de cuisine pour micro-ondes et les emballages alimentaires en raison de leur stabilité thermique, de leur résistance aux huiles et graisses. Encore meilleure est leur transparence au rayonnement micro-onde. Ils peuvent également être utilisés dans les circuits imprimés, l'isolation, les fibres pour vêtements de protection, les composites et les adhésifs.
Les polyimides sont auto-extinguibles, ce qui signifie qu'ils peuvent commencer à brûler puis s'éteindre rapidement. Au niveau moléculaire, cela signifie que lorsque la flamme touche le polyimide, un charbon de surface se développe qui l'étouffe, le bloquant de l'oxygène nécessaire à sa combustion.
Synonymes, antonymes
Voir tous les synonymes pour "polyimide".1 synonyme (sens proche) de "polyimide" :
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à POLYIMIDE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot POLYIMIDE est dans la page 7 des mots en P du lexique du dictionnaire.
Mots en P à proximité
polygyniepolyhalin polyholoside polyhydroxyalkanoate polyhydroxylé polyimidepolymère polymérisation polymérisation en chaîne polymétamorphisme polymictique
En rapport avec "polyimide"
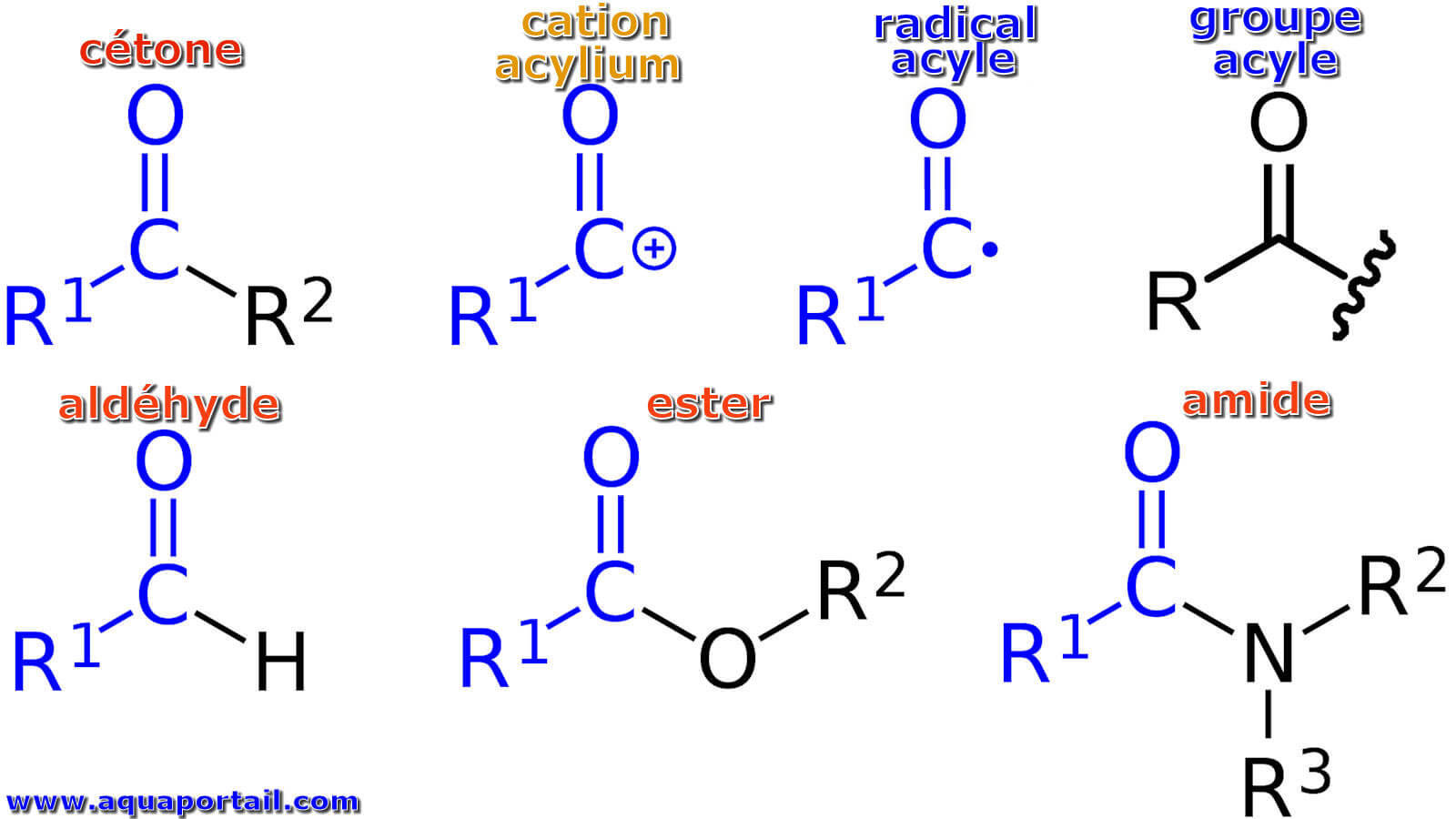
Un acyle est un radical de formule générale –C(O)R, où R est un radical organyle (alkyle, aryle, etc.

Les imides sont des dérivés monoacylés d'amides ou de lactames et sont utilisés comme intermédiaires précieux dans la synthèse organique ainsi que dans...

Un polymère est une molécule constituée d'une chaîne de molécules semblables et répétitives, appelées monomères.
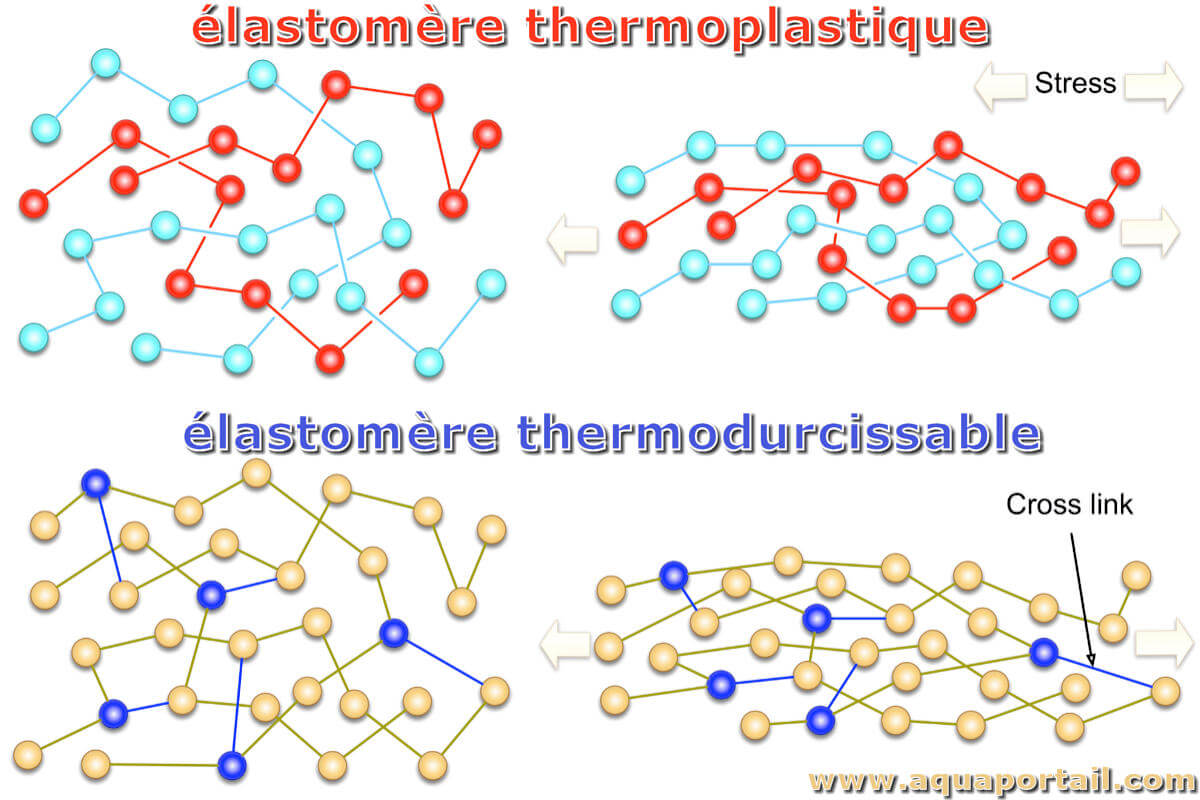
Un thermoplastique est un polymère qui peut être ramolli et fondu par l'application de chaleur, et peut être traité soit à l'état ramolli à la chaleur (par...
