Réaction exergonique
Définition
Une réaction exergonique est une réaction chimique qui libère de l'énergie libre, contrairement à un processus endergonique dans une réaction endergonique. Une réaction exergonique est une réaction chimique spontanée. Que la réaction soit spontanée signifie que le changement d'énergie libre est négatif. En biologie, les réactions du catabolisme sont exergoniques.
Dans un système de pression et de température constantes, qui s'applique à la plupart des réactions chimiques, l'énergie libre de Gibbs est négative. Au contraire, le système a un volume et une température constants : l'énergie de Helmholtz utilise de l'énergie libre.
Schéma d'une réaction exergonique :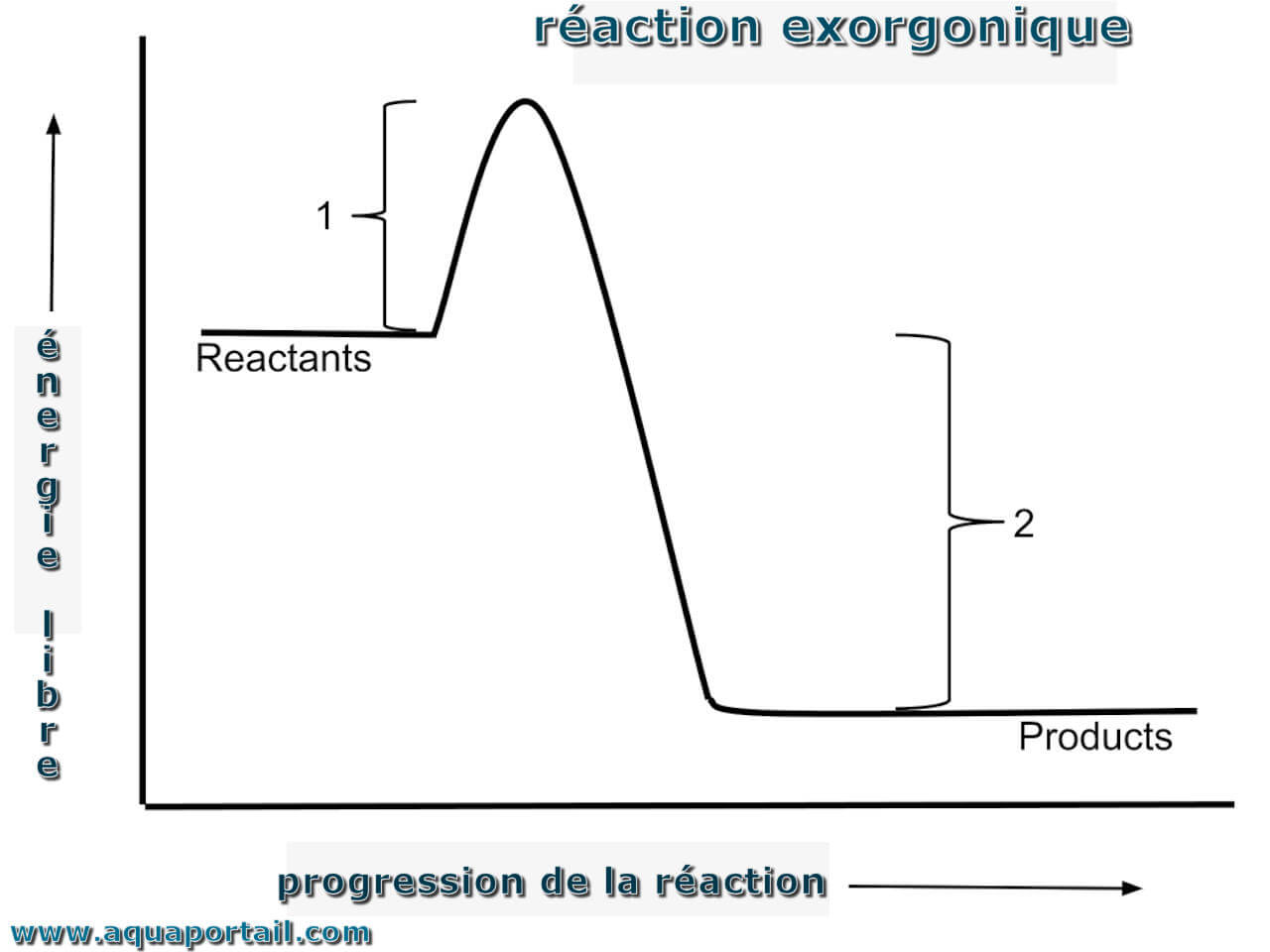
Une réaction exergonique (telle que la respiration cellulaire) est une réaction qui perd de l'énergie lors du processus de réaction. L'énergie d'activation (1) catalyse la réaction de manière spontanée. La progression de la réaction est indiquée par la ligne. Le changement d'énergie libre de Gibbs (ΔG) dans une réaction exergonique (qui survient dans des conditions de pression et de température constantes) est une valeur négative car de l'énergie est perdue.
Explications
Qu'une réaction soit exergonique dit juste quelque chose à propos des états de départ et de fin et pas à quelle vitesse cela va. Une énergie d'activation peut être nécessaire pour limiter la vitesse de réaction.
Un exemple d'une réaction exergonique est lorsque l'hydrogène et l'oxygène réagissent et forment de l'eau.
Plus complètement, une réaction exergonique décrit une réaction chimique qui libère de l'énergie sous forme de chaleur, de lumière, etc. Les réactions exergoniques sont une forme de processus exergoniques en général ou des processus spontanés et sont le contraire des réactions endergoniques. Il a été dit que les réactions exergoniques existent spontanément mais cela ne signifie pas que la réaction se déroulera sans aucune limitation ou problème. Par exemple, la vitesse de réaction entre l'hydrogène et l'oxygène est très lente et n'est pas observée en l'absence d'un catalyseur approprié.
Les réactions exergoniques libèrent plus d'énergie qu'elles n'en absorbent; en elle, la formation de nouvelles liaisons des produits (dans la réaction chimique) libère une quantité d'énergie supérieure à celle absorbée pour rompre les liaisons des réactifs, de sorte que l'excès est libre au fur et à mesure de la réaction. Régulièrement les réactions cataboliques sont exergoniques.
En thermodynamique, le travail est défini comme une énergie qui sort du système en dehors du système au cours d'un processus ou d'une réaction. Dans un processus exergonique, de l'énergie est fournie à l'environnement du système, tandis que dans un processus endergonique, l'énergie est extraite de l'environnement du système. Les réactions à pression et température constantes ne sont exergoniques que si le changement d'énergie libre de Gibbs est négatif (G<0).
Tous les systèmes chimiques et physiques suivent la deuxième loi de la thermodynamique et fonctionnent dans le sens exergone. Ainsi, dans tous les processus et réactions spontanés, l'énergie libre d'un système est réduite et convertie en travail.
Une réaction chimique est donc exergone si elle survient spontanément. Avec ce type de réaction, l'énergie libre diminue. Entropy est également impliqué dans cela. Si l'entropie n'est pas prise en compte, il est alors fait référence à une réaction exothermique. L'évolution de l'énergie libre de Gibbs est décrite par l'équation de Gibbs-Helmholtz : ΔG = ΔH - T ⋅ ΔS
(où: T = température en Kelvin (K); ΔG = changement d'énergie libre, ΔS = changement d'entropie (à 298 K) selon ΔS = Σ{S (produit de réaction)} - Σ{S (réactif)}; ΔH = modification enthaliale (à 298 K) selon ΔH = Σ{H (produit de réaction)} - Σ{H (réactif)}.)
Une réaction chimique n'existe spontanément que si l'enthalpie libre de réaction ΔG est négative. Avec les réactions exergone, l'énergie est libérée car le ΔG est négatif et avec les réactions en sous-énergie, elle est utilisée car le Δ G est positif :
- ΔR G < 0 : exergonique;
- ΔR G > 0 : endergonique.
Bien que l'on dise que les réactions exergoniques existent spontanément, cela ne signifie pas que la réaction aura lieu à une vitesse observable. Par exemple, la dismutation du peroxyde d'hydrogène est très lente en l'absence d'un catalyseur approprié.
Synonymes, antonymes
Voir tous les synonymes pour "réaction exergonique".0 synonyme (sens proche) pour "réaction exergonique".
1 antonyme (sens contraire) :
Les mots ou les expressions apparentés à RÉACTION EXERGONIQUE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
L'expression REACTION EXERGONIQUE est dans la page 1 des mots en R du lexique du dictionnaire.
En rapport avec "réaction exergonique"

Le cycle trophogonique (cycle gonotrophique), chez les moustiques, consiste en une succession de phénomènes physiologiques, Il débute à partir d'un repas...
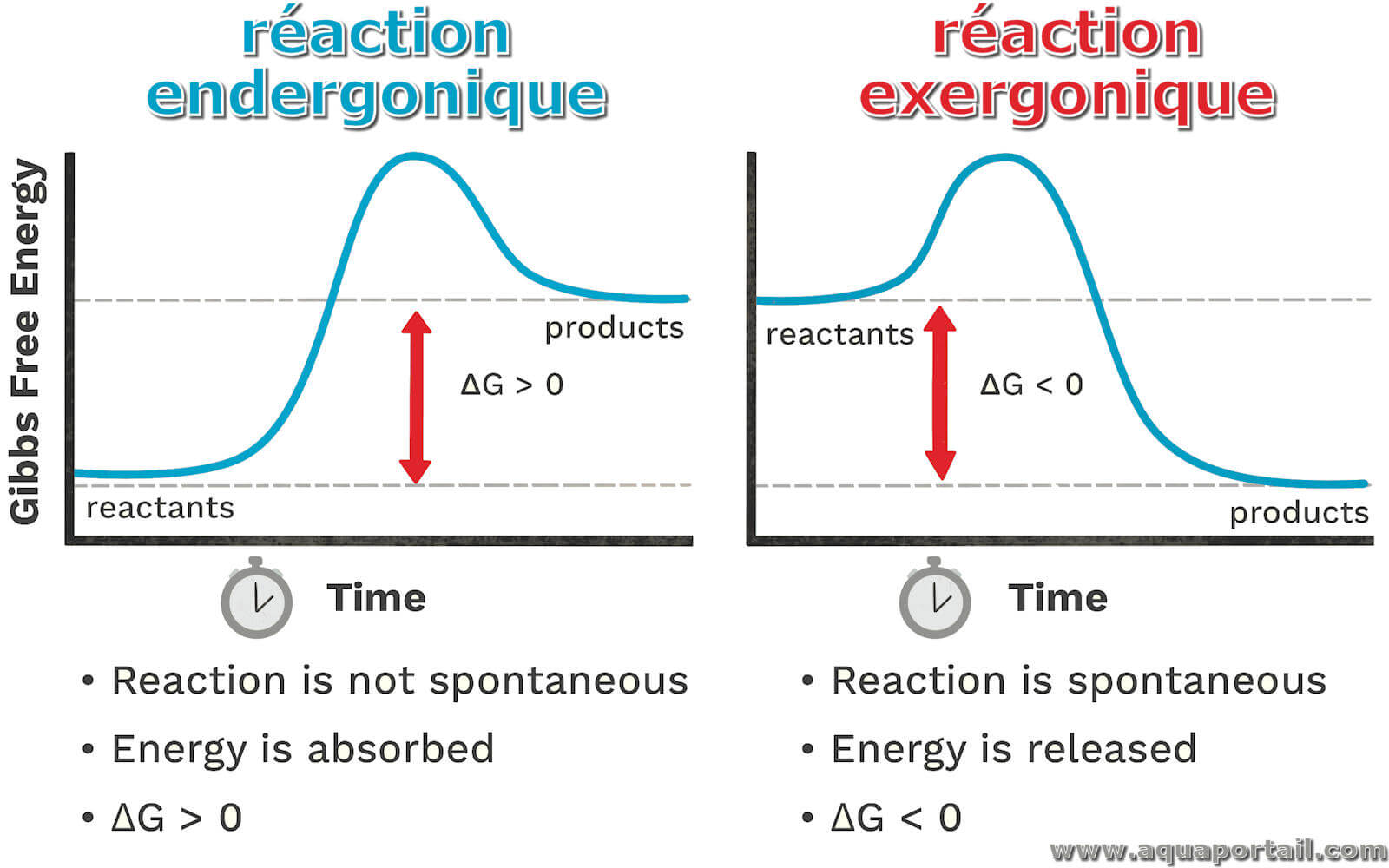
Une réaction endergonique est une réaction chimique non spontanée qui nécessite l'absorption d'énergie, soit endergonique, par opposition à une réaction...

Une alcali réaction est une réaction chimique dans les bétons avec les composés du ciment, entre la silice de granulats et les alcalins de la pâte de ciment.
centres réactionnels de la photosynthèse

Les centres réactionnels de la photosynthèse sont des centres privilégiés de la photosynthèse où des réactions d'oxydoréduction interviennent.
