Ammoniac
Définition
L'ammoniac est un gaz incolore composé de 82 % d'azote (N) et de 18 % d'hydrogène (H) dont la formule chimique est NH3. Il a une forte odeur nauséabonde désagréable. Assez toxique, il peut irriter la peau, les yeux, le nez, la gorge et les poumons.
Une molécule d'ammoniac :
L'ammoniac est un gaz incolore et odorant, de masse molaire 17,03 g/mol, avec un point de fusion à -77,7 °C et un point d'ébullition à -33 °C. La densité est de 0,7714 kg/m3 (0 °C, 1013 mbar).
Explications
L'ammoniac est un composé alcalin gazeux incolore et piquant d'azote et d'hydrogène NH3 qui est très soluble dans l'eau et peut facilement être condensé en liquide par le froid et la pression Ce gaz incolore a une odeur piquante caractéristique. Il se dissout dans l'eau pour donner une solution fortement alcaline.
L'ammoniac est produit par les bactéries et les plantes et animaux en décomposition (anaérobie) et est présent dans l'eau, le sol et l'air. L'ammoniac est également produit par les organismes lors de la dégradation des protéines dont il est un élément constitutif. Il sert de précurseur à la synthèse des acides aminés et des nucléotides.
C'est une source importante d'azote dont les plantes et les animaux ont besoin. Il est transformé au cours du cycle de l'azote. Il existe sous forme d'ion ammonium (NH4+) au pH physiologique.
L'ammoniac peut être liquéfié et utilisé dans les médicaments, les engrais, les produits d'entretien ménager et d'autres produits. Il intervient dans la composition de certains explosifs. Il est également ajouté aux cigarettes pour augmenter l'effet de la nicotine sur l'organisme. Des solutions d'ammoniac sont utilisées comme liquide de nettoyage.
À l'état pur, on l'appelle ammoniac anhydre ou gaz d'ammonium.
lire plus de détails pour l'ammoniac...
Synonymes, antonymes
Voir tous les synonymes pour "ammoniac".3 synonymes (sens proche) de "ammoniac" :
- ammoniac anhydre
- gaz ammoniacal
- gaz d'ammonium
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à AMMONIAC sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot AMMONIAC est dans la page 5 des mots en A du lexique du dictionnaire.
Mots en A à proximité
aminoside aminotransférase amitose Ammanie ammocète ammoniacammoniaque ammonifiant ammonification ammoniotélisme ammonisation
En rapport avec "ammoniac"
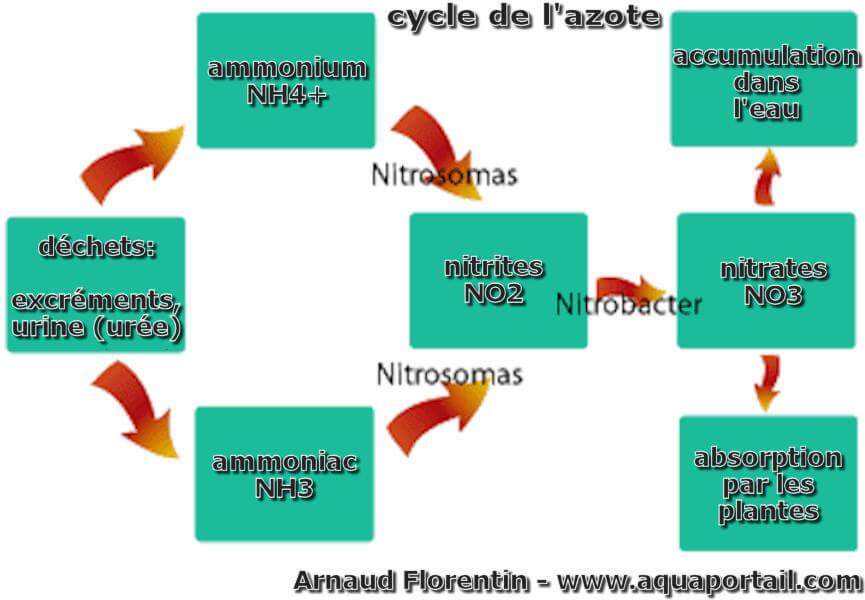
Le cycle de l'azote est une succession de processus naturels qui transforment l'azote N en substances organiques : ammoniac, ammoniaque, nitrite et nitrate...

L'ammoniaque (hydroxyde d'ammonium) est la solution aqueuse basique de l'ammoniac, de symbole NH3(aq).

L'ammonification est le processus par lequel des organismes microscopiques comme des bactéries ou d'autres types d'organismes en décomposition, décomposent...

L'ammonisation est la transformation de l'azote organique (matière vivante, déchets organiques) en azote ammoniacal (ammoniac, ammoniaque, nitrites...
