Acide chromique
Définition
L'acide chromique est un acide diprotique de type diacide et oxacide de formule H2CrO4. Ce puissant agent oxydant est largement utilisé dans diverses industries en raison de ses propriétés chimiques.
La structure de l'acide chromique :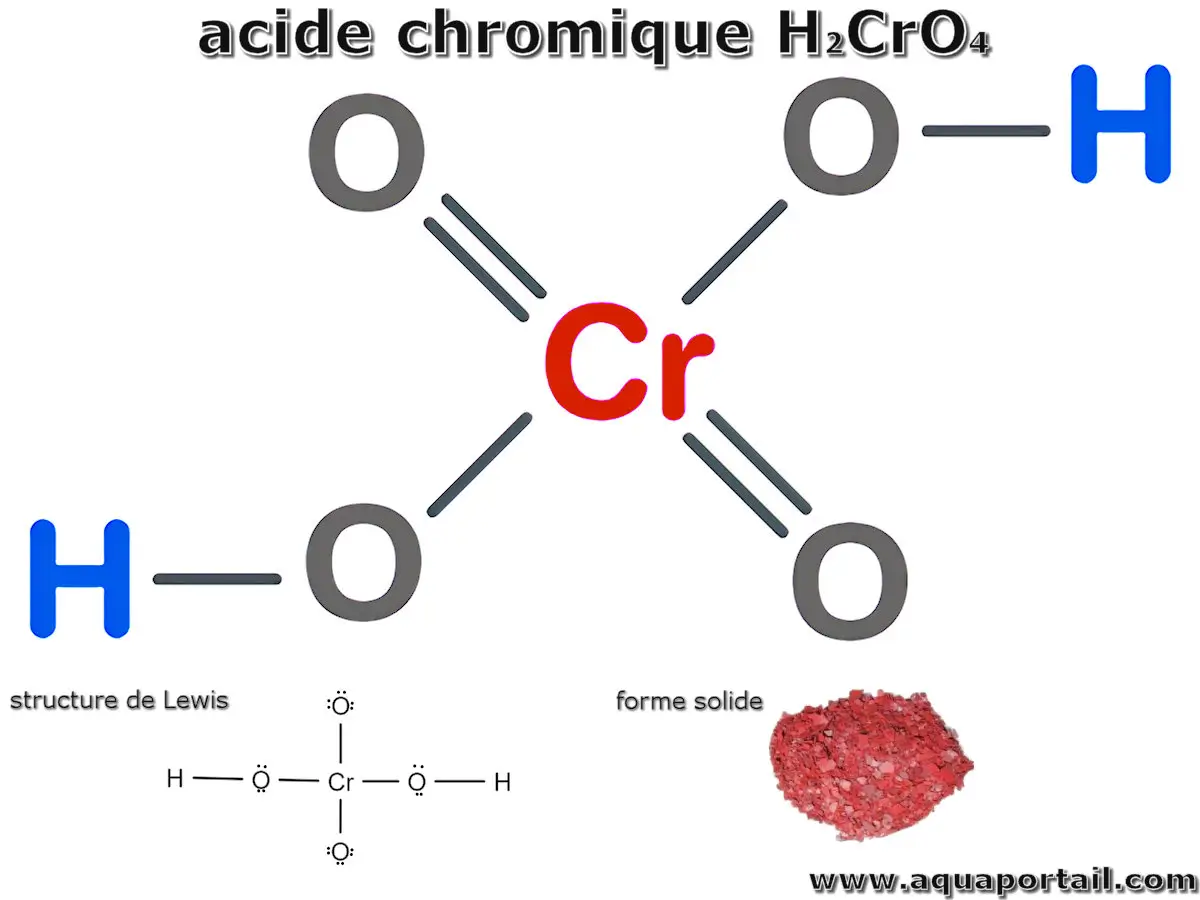
Le nom de l'acide chromique H2CrO4, défini par l'UICPA (Union internationale de chimie pure et appliquée), est le dihydroxydo-dioxydochrome. Il est encore appelé l'acide tétraoxochromique. La structure moléculaire de l'acide chromique présente un atome de chrome central lié à quatre atomes d'oxygène. Parmi ces liaisons, deux sont des liaisons simples Cr-H-O, tandis que les deux autres sont des liaisons doubles Cr=O. Cet arrangement complexe explique la réactivité de l'acide chromique et son large champ d'application dans les domaines industriel et esthétique.
Explications
L'acide chromique est produit par réaction du trioxyde de chrome avec l'eau. Le trioxyde de chrome se présente sous forme cristalline, de couleur rouge clair ou brune, et est très déliquescent, se dissolvant complètement dans l'eau. Malgré son nom, l'acide chromique est un acide très faible, et ses sels peuvent être facilement dissociés, même avec l'acide acétique. Il peut aussi être préparé par réaction d'un sel de dichromate, comme le dichromate de potassium, avec de l'acide sulfurique.
L'acide chromique est classé comme un acide inorganique couramment utilisé dans diverses applications décoratives et industrielles, comme la patine des instruments de musique, notamment les guitares, les pianos et les cuivres. Le ternissement caractéristique de l'acide chromique améliore l'esthétique et la préservation de ces objets. Sa formule moléculaire, H₂CrO₄, désigne une composition composée de deux atomes d'hydrogène, quatre atomes d'oxygène et un atome de chrome. L'acide chromique se présente comme un composé neutre, formé par l'interaction d'ions hydrogène (H+) et d'ions chromate polyatomiques (CrO42-).
La charge globale s'équilibre à zéro grâce à l'équation suivante : CrO42- + 2H+ → H2CrO4
L'acide chromique est reconnu comme une substance inodore aux applications variées. Il est un ingrédient clé dans l'émaillage céramique et modifie esthétiquement les surfaces en laiton en leur conférant une patine. Il est également essentiel aux procédés de chromage et est largement utilisé pour le nettoyage de la verrerie de laboratoire lorsqu'il est dissous dans des solutions d'acide sulfurique. De plus, l'acide chromique est utile comme agent de préservation du bois et entre dans la composition de certaines teintures capillaires. Sa forte acidité provient de sa capacité à donner des protons; en solution aqueuse, un ion hydrogène réagit généralement avec les molécules d'eau pour former des ions hydronium (H3O+).
Le terme "chromique" dans l'acide chromique provient de l'ion polyatomique chromate. Un ion polyatomique est essentiellement une molécule portant une charge électrique. Le chromate possède une charge de moins deux et est représenté par la formule CrO42-. Parallèlement, un atome d'hydrogène perd son unique électron et devient un ion hydrogène chargé positivement, H+.
Comme le chromate a une charge de -2 et l'hydrogène une charge de +1, deux ions hydrogène sont nécessaires pour se lier à un seul ion chromate afin de créer un composé électriquement neutre. Ce composé a pour formule H2CrO4 (aq), où (aq) signifie que la substance est un acide sous sa forme aqueuse, c'est-à-dire dissoute dans l'eau.
Structure
La structure de l'acide chromique est composée d'un atome de chrome central coordonné par quatre atomes d'oxygène. Parmi ceux-ci, deux atomes d'oxygène sont liés individuellement à l'atome de chrome et à un atome d'hydrogène par des liaisons simples, tandis que les deux atomes d'oxygène restants forment des liaisons doubles avec l'atome de chrome.
Chimiquement, l'acide chromique est constitué de deux ions hydrogène chargés positivement (H+) et d'un ion chromate chargé négativement (CrO42-). La formule de l'acide chromique est H2CrO4, ce qui reflète la neutralisation de la charge -2 de l'ion chromate par deux ions hydrogène. Ce composé peut être synthétisé par réaction de l'acide sulfurique avec un sel de dichromate, tel que le dichromate de potassium.
De plus, le trioxyde de chrome (formule chimique CrO3) représente l'anhydride acide de l'acide chromique (H2CrO4). Structurellement distinct mais apparenté, le trioxyde de chrome forme une variante déshydratée de l'acide chromique dans des conditions spécifiques.
L'arrangement structural commence par l'identification de l'atome le moins électronégatif, le chrome, comme atome central, entouré de quatre atomes d'oxygène. Deux de ces atomes d'oxygène forment chacun des liaisons simples avec l'atome de chrome et un atome d'hydrogène. Les deux atomes d'oxygène restants forment des doubles liaisons avec l'atome de chrome. Cet arrangement crée deux doubles liaisons Cr=O et met en évidence les caractéristiques géométriques et électroniques de la molécule.
Synonymes, antonymes
Voir tous les synonymes pour "acide chromique".4 synonymes (sens proche) de "acide chromique" :
- acide tétraoxochromique
- diacide chromique
- dihydroxydo-dioxydochrome
- Voir la suite...
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à ACIDE CHROMIQUE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
L'expression ACIDE CHROMIQUE est dans la page 1 des mots en A du lexique du dictionnaire.
Mots en A à proximité
acide carbonique acide carboxylique acide cérébronique acide chlorhydrique acide cholique acide chromiqueacide citrique acide clavulanique acide cyanhydrique acide désoxycholique acide désoxyribonucléique
En rapport avec "acide chromique"

Un acide diprotique est un acide polyprotique pouvant céder deux protons à d'autres atomes.

Un diacide est la forme la plus simple d'un polyacide, avec deux atomes d'hydrogène acides remplaçables.
Un oxacide, oxyacide ou oxoacide, est un acide contenant de l'oxygène. Cet acide dont la formule renferme de l'oxygène est l'opposé d'un hydracide.

L'acide acétique (CH₃COOH) est un acide organique qui donne au vinaigre son goût caractéristique.
