Neurogenèse
Définition
La neurogenèse est le processus par lequel de nouveaux neurones se forment dans le cerveau. Elle est cruciale lors du développement d'un embryon. Mais la neurogenèse se poursuit également dans certaines régions du cerveau après la naissance et tout au long de la vie.
La neurogenèse adulte :
La neurogenèse adulte dans l'hippocampe : les cellules souches (rouge) donnent naissance à des cellules progénitrices à prolifération rapide (orange-jaune) qui sortent finalement du cycle cellulaire (vert) et mûrissent en neurones nouveau-nés (bleu). Elles s'intègrent dans le réseau de cellules granulaires environnantes (gris).
En résumé
Le cerveau mature a de nombreux domaines fonctionnels spécialisés et des neurones qui diffèrent par leur structure et leurs connexions. L'hippocampe, par exemple, qui est une région du cerveau qui joue un rôle important dans la mémoire et la navigation spatiale, compte à lui seul au moins 27 types de neurones différents.
L'incroyable diversité des neurones dans le cerveau résulte d'une neurogenèse régulée au cours du développement embryonnaire. Au cours du processus, les cellules souches neurales se différencient, c'est-à-dire qu'elles deviennent l'un des nombreux types de cellules spécialisées, à des moments et dans des régions spécifiques du cerveau.
Explications
Le développement du système nerveux central (SNC) des mammifères est un processus régulé spatial et temporel qui évolue à partir d'un petit nombre de cellules qui prolifèrent, acquièrent des identités régionales et donnent naissance à différents types cellulaires. Ces cellules ont été classées comme cellules souches neurales (NSC) et ont la capacité de produire une progéniture identique de NSC par division cellulaire symétrique (auto-renouvellement) et de se différencier en types de cellules cérébrales spécialisées telles que les neurones, les astrocytes et les oligodendrocytes. Dans des conditions physiologiques, la neurogenèse adulte est confinée dans des niches neurogènes localisées dans deux régions différentes du cerveau, la zone sous-ventriculaire (SVZ) du ventricule latéral où de nouveaux neurones sont générés puis migrent vers le bulbe olfactif (OB), et la zone sous-granulaire (SGZ) du gyrus denté (DG) de l'hippocampe.
Bien que le processus de neurogenèse soit complexe et hautement régulé, il peut être divisé en six étapes différentes. Le stade 1 survient 1 à 3 jours après la naissance et s'appelle la phase de prolifération; pendant ce temps, les cellules progénitrices neuronales (NPC) sont capables de prolifération et de différenciation multipotentes mais sont incapables de s'auto-renouveler. Les stades 2 à 4 interviennent environ 1 semaine après la naissance et sont collectivement appelés la phase de différenciation; pendant ce temps, les progéniteurs neuronaux sortent du cycle cellulaire et sont engagés dans la lignée neuronale. Après l'engagement, les neurones immatures entrent dans l'étape 5, connue sous le nom de phase de migration, pour atteindre leur destination finale. Cet événement survient entre 2 à 3 semaines après la naissance. Les neurones post-mitotiques commencent à étendre leurs projections axonales et la croissance dendritique commence. Enfin, l'étape 6 de la neurogenèse adulte intervient environ 4 semaines après la naissance et correspond à l'intégration synaptique où les neurones nouvellement générés établissent leurs contacts synaptiques dans les circuits préexistants. Dans l'ensemble, il faut environ 2 à 4 mois pour que des neurones nés adultes indiscernables s'intègrent pleinement aux cellules environnantes et s'intègrent dans les circuits hippocampiques.
De multiples sources de données indiquent que des signaux extrinsèques et des voies intrinsèques sont nécessaires pour la régulation de ce processus de développement. Parmi les voies intrinsèques, les réseaux de régulation multicouches affichent des connexions entre plusieurs facteurs de transcription complexes, le contrôle épigénétique, les ARN non codants, la signalisation et les voies métaboliques.
Comprendre comment la différenciation neuronale est régulée à l'âge adulte est crucial pour comprendre la pathogenèse de plusieurs troubles qui affectent le SNC, notamment les maladies neurodégénératives, les troubles psychiatriques et neurodéveloppementaux.
Neurogenèse adulte
La neurogenèse adulte est un processus en plusieurs étapes par lequel les neurones sont générés et intégrés dans les circuits neuronaux existants. Dans le cerveau adulte, la neurogenèse est principalement localisée dans deux niches spécialisées, la zone sous-granulaire (SGZ) du gyrus denté et la zone sous-ventriculaire (SVZ) adjacente aux ventricules latéraux.
La neurogenèse joue un rôle fondamental dans le cerveau postnatal, où elle est nécessaire à la plasticité neuronale. De plus, la perturbation de la neurogenèse adulte contribue à plusieurs maladies humaines, notamment les troubles cognitifs et les maladies neurodégénératives. L'interaction entre les facteurs extrinsèques et intrinsèques est fondamentale dans la régulation de la neurogenèse.
Les principales étapes de la neurogenèse adulte :
Représentation schématique des principales étapes de la neurogenèse et de la machinerie épigénétique impliquée dans la régulation de la neurogenèse avec la synaptogenèse. Profil d'expression des principaux régulateurs épigénétiques pour lesquels une fonction dans la neurogenèse adulte a été décrite ou proposée. La plupart des régulateurs jouent un rôle important dans l'auto-renouvellement, la prolifération et la spécification du devenir au cours de la neurogenèse
Au cours des dernières décennies, plusieurs études sur les voies intrinsèques, dont les facteurs de transcription, ont mis en évidence leur rôle fondamental dans la régulation de chaque étape de la neurogenèse. Cependant, il est probable que la régulation transcriptionnelle fasse partie d'un réseau de régulation plus sophistiqué, qui comprend des modifications épigénétiques, des ARN non codants et des voies métaboliques.
Les découvertes récentes font progresser les connaissances sur la régulation épigénétique, transcriptionnelle et métabolique de la neurogenèse adulte dans la SGZ de l'hippocampe, avec une attention particulière à la famille p53 des facteurs de transcription.
Neurogenèse rétinienne chez les vertébrés
Les neurones rétiniens intègrent et transmettent essentiellement toutes les informations visuelles que nos yeux voient au cerveau. Les défauts de développement rétinien entraînent une vision anormale. Curieusement, les cellules rétiniennes en développement sont capables de choisir plusieurs destins, mais finissent par devenir un seul type de cellule. Une meilleure compréhension de ces principes facilitera la conception future de thérapies plus efficaces contre les maladies de la rétine.
Au début de la croissance de la vésicule optique et de la cupule, les cellules progénitrices entrent en contact avec les deux côtés du tissu, sauf lors de la division. Pendant la mitose, les cellules progénitrices rétractent les processus cellulaires de chaque surface, se divisent apicalement, puis se rattachent aux deux bords. De plus, les noyaux RPC subissent des mouvements nucléaires intercinétiques, entre les surfaces apicales et basales de l'oeil. En phase S, les noyaux sont situés à la base, mais migrent vers la surface apicale pendant la phase G2. Les premiers RPC sortant du cycle cellulaire migrent vers la base. Un repère architectural qui accompagne la neurogenèse rétinienne est le laminage tissulaire, induit par des vagues de progéniteurs, se différenciant et s'accumulant en couches, où ils étendent un axone et forment une connexion synaptique.
La rétine mature contient trois couches cellulaires : la couche nucléaire externe (ONL), la couche nucléaire interne (INL) et la couche de cellules ganglionnaires (GCL). Les neurones sensoriels primaires de la rétine sont des photorécepteurs, qui absorbent les photons de lumière dans leurs segments externes, et sont divisés en deux grandes classes : les bâtonnets (détectent la lumière faible) et les cônes (détectent la lumière vive et la couleur).
Les neurones bipolaires transmettent les informations des photorécepteurs aux cellules ganglionnaires rétiniennes (RGC), qui à leur tour transmettent ces informations sensorielles à des régions particulières du cerveau. Les neurones amacrines et horizontaux modulent et intègrent les signaux visuels dans les circuits rétiniens. Dans la rétine des vertébrés adultes, les noyaux gliaux de Müller résident dans l'INL, mais leurs corps cellulaires s'étendent sur toute la largeur.
Synonymes, antonymes
Voir tous les synonymes pour "neurogenèse".1 synonyme (sens proche) de "neurogenèse" :
- synaptogenèse
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à NEUROGENÈSE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot NEUROGENESE est dans la page 1 des mots en N du lexique du dictionnaire.
Mots en N à proximité
neuroblaste neurocrâne neurofibrille neurofilament neurogemme neurogenèseneurohormone neurohypophyse neurolemme neurolemmocyte neurolyse
En rapport avec "neurogenèse"
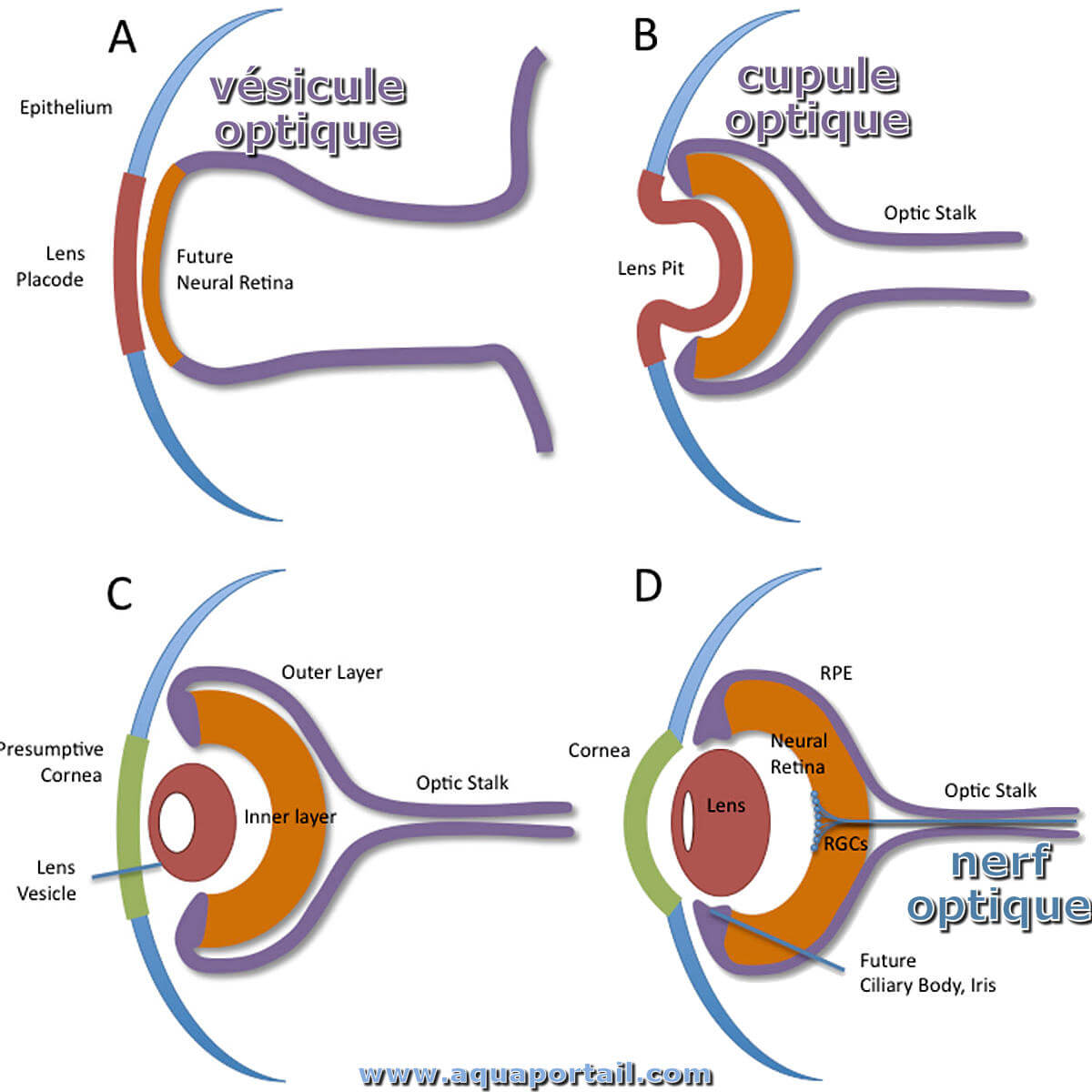
La vésicule optique (cupule optique) est une évagination de chaque paroi latérale du cerveau antérieur des vertébrés embryonnaires à partir de laquelle...
La neurobiologie est l'étude des cellules du système nerveux et l'organisation de ces cellules en circuits fonctionnels qui traitent l'information et modèlent...
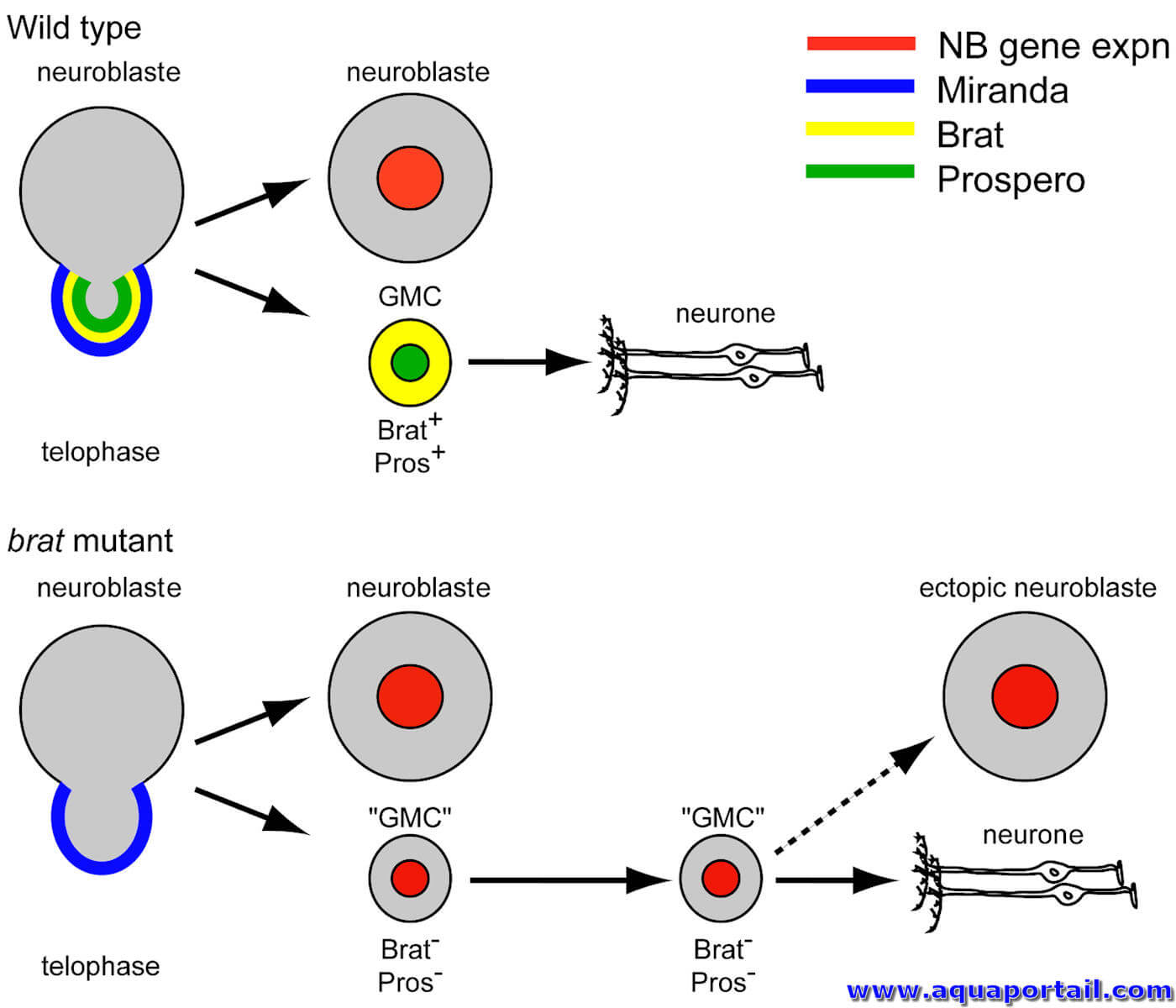
Un neuroblaste désigne des neurones immatures, lors de l'embryogenèse. Chez les embryons de Cordés, le neuroblaste distingue la partie dorsale de l'ectoblaste...

La neurofibrille qualifie le faisceau de neurofilaments dans l'axone d'un neurone. Les neurofibrilles constituent le système de soutien (par des filaments)...
