Théorie des collisions
Définition
La théorie des collisions établit que les réactions chimiques surviennent lorsque des molécules réactives entrent en collision avec une énergie suffisante (supérieure à l'énergie d'activation) et une orientation appropriée. Seules certaines collisions entraînent la formation de produits, les vitesses de réaction étant liées à ces collisions effectives.
La théorie des collisions moléculaires :
La théorie des collisions stipule que pour qu'une réaction chimique intervienne, les particules qui réagissent doivent entrer en collision les unes avec les autres. Les molécules réactives doivent entrer en collision pour initier des réactions. Les molécules ont besoin de suffisamment d'énergie pour franchir les barrières d'activation, permettant ainsi la transformation des liaisons. Les collisions doivent s'aligner correctement pour former de nouvelles liaisons; les impacts mal alignés sont inefficaces.
Explications
La théorie des collisions est une théorie selon laquelle les réactions chimiques sont dues au fait que les particules acquièrent de l'énergie lorsqu'elles entrent en collision. Elle est limitée aux gaz car les fréquences des collisions atomiques ne peuvent être calculées avec précision qu'avec les gaz. Max Trautz a proposé la théorie des collisions en 1916, ainsi que William Lewis indépendamment en 1918.
Cette théorie mécanique du déroulement des réactions chimiques a été développée en 1916 par Max Trautz et en 1918 par le chimiste britannique William Lewis. Ils expliquent qualitativement comment les réactions chimiques interviennent et pourquoi les taux de réaction diffèrent pour diverses réactions.
On suppose avec la théorie des collisions moléculaires que pour une réaction, une collision doit avoir lieu entre les deux partenaires de réaction, dans laquelle un certain seuil d'énergie doit être dépassé le long de l'axe de connexion noyau-noyau.
La théorie des collisions fournit des valeurs utiles, en particulier pour de simples réactions en phase gazeuse entre des ions sphériques.
Facteurs de réussite
Pour qu'une réaction intervienne, les particules qui réagissent doivent entrer en collision. Seule une certaine fraction du total des collisions provoque un changement chimique; on les appelle des collisions réussies. Les collisions réussies ont une énergie suffisante (énergie d'activation), lors de l'impact, pour rompre les liaisons existantes et former de nouvelles liaisons, résultant en les produits de réaction
L'augmentation de la concentration des réactifs et l'augmentation de la température conduit à plus de collisions et donc à des collisions plus réussies, augmentant la vitesse de la réaction. Des quantités plus importantes de réactifs augmentent les vitesses de collision, accélérant ainsi les réactions. Des températures plus élevées augmentent l'énergie cinétique moléculaire, augmentant ainsi la fréquence et le succès des collisions.
Les catalyseurs réduisent l'énergie d'activation, améliorant ainsi le succès des collisions et accélérant les réactions. Lorsqu'un catalyseur est impliqué dans la collision entre des molécules de réactif, il faut moins d'énergie pour que le changement chimique intervienne, et donc plus de collisions ont assez d'énergie pour que la réaction existe. La vitesse de réaction augmente en conséquence. La vitesse de réaction dépend de la phase réactive et de la surface de l'interface.
La théorie des collisions est étroitement liée à la cinétique chimique. Elle stipule que pour qu'une réaction ait lieu, les réactifs doivent entrer en collision correctement. La vitesse de réaction est égale à la fréquence des collisions.
Synonymes, antonymes
Voir tous les synonymes pour "théorie des collisions".1 synonyme (sens proche) de "théorie des collisions" :
- théorie des réactions chimiques
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à THÉORIE DES COLLISIONS sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
L'expression THEORIE DES COLLISIONS est dans la page 2 des mots en T du lexique du dictionnaire.
Mots en T à proximité
théorie de Darwin théorie de l'endosymbiose théorie de l'évolution théorie de la récapitulation théorie des causes finales théorie des collisionsthéorie des signatures thèque théqué thérapie thérapie génique
En rapport avec "théorie des collisions"

Un catalyseur est une substance qui augmente la vitesse d'une réaction chimique sans être consommée et sans modifier la position finale de l'équilibre...

La concentration (géographique) est le regroupement de nombreux éléments au centre d'un même lieu.

Une réaction chimique transforme des réactifs en produits par réarrangement des atomes et en formant de nouvelles substances.
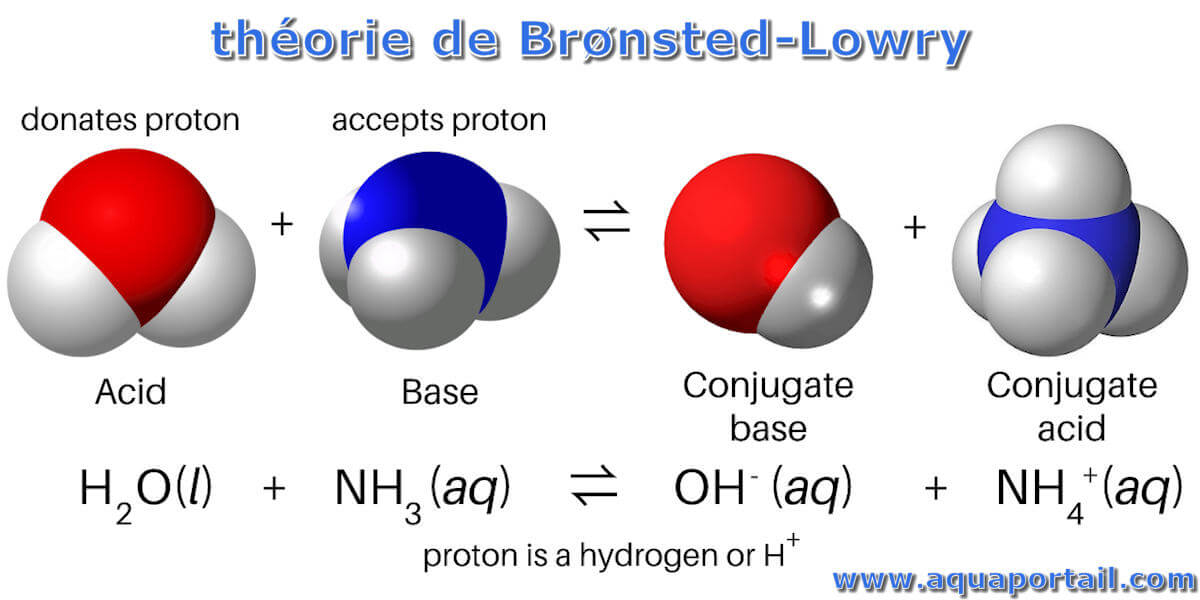
La théorie de Brønsted-Lowry est la théorie des protons des acides et des bases qui stipule qu'un acide donne un proton (ion hydrogène, H⁺), tandis qu'une base...
