Spectre d'émission
Définition
Un spectre d'émission est le spectre électromagnétique émis par des atomes, des molécules ou des matériaux sans émission de rayonnement électromagnétique de même fréquence. La contrepartie d'un spectre d'émission est l'absorption avec le spectre d'absorption. Tandis que des niveaux discrets d'énergie génèrent un spectre linéaire, les bandes d'énergie provoquent un spectre continu.
Le spectre d'émission du Fer :
Le spectre d'émission atomique d'un élément comme le fer (Fe) est un ensemble de fréquences d'ondes électromagnétiques émises par des atomes de cet élément, à l'état gazeux, lorsque de l'énergie lui est communiquée. Le spectre d'émission de chaque élément est unique et peut être utilisé pour déterminer si cet élément fait partie d'un composé inconnu. Le fait que seules quelques couleurs apparaissent dans les émissions atomiques des éléments signifie que seules certaines fréquences de la lumière sont émises.
Explications
En chimie, un spectre d'émission fait référence à la gamme de longueurs d'onde émises par un atome ou un composé stimulé par la chaleur ou le courant électrique. Un spectre d'émission est propre à chaque élément. Le spectre d'émission du combustible brûlant ou d'autres molécules peut également être utilisé pour illustrer sa composition. Voir aussi le spectre d'action, le spectre lumineux et le spectre visible.
Si le spectre d'absorption d'une étoile permet de déterminer de quels éléments elle est constituée en fonction des couleurs de la lumière qu'elle absorbe, le spectre d'émission d'une nébuleuse lumineuse permet de déterminer de quels gaz elle est composée en fonction des couleurs qu'elle émet. Les deux spectres se complètent car chaque élément a son propre spectre unique.
Différents éléments ont des spectres différents car ils ont un nombre différent de protons, ainsi qu'un nombre et une disposition d'électrons différents. Les différences de spectres reflètent les différences dans la quantité d'énergie que les atomes absorbent ou dégagent lorsque leurs électrons se déplacent entre les niveaux d'énergie.
Les molécules, comme l'eau, le dioxyde de carbone et le méthane, ont également des spectres distincts. Même si cela devient un peu plus compliqué, l'idée de base est la même. Les molécules peuvent absorber des bandes de lumière spécifiques, correspondant à des changements discrets d'énergie. Dans le cas des molécules, ces changements d'énergie peuvent être liés à des sauts d'électrons, mais peuvent également être liés aux rotations et vibrations des molécules.
Spectre atomique
Un spectre atomique est le spectre d'émission d'un seul atome isolé, c'est-à-dire l'intensité de la lumière qu'il émet (émise) en fonction de la longueur d'onde (ou de la fréquence). Les spectres atomiques sont définis comme le spectre du rayonnement électromagnétique émis ou absorbé par un électron lors des transitions entre différents niveaux d'énergie au sein d'un atome.
Lorsqu'un électron passe d'un niveau d'énergie à un autre, il émet ou absorbe de la lumière d'une longueur d'onde spécifique. La collection de toutes ces longueurs d'onde spécifiques de l'atome dans un ensemble donné de conditions comme la pression, la température, etc. constitue le spectre atomique des atomes. Il existe trois types de spectres atomiques : les spectres d'émission, les spectres d'absorption et les spectres continus.
Le spectre d'émission d'une lampe à fluorescence (figure 1) :
Deux représentations du spectre d'émission d'une lampe à fluorescence; les nombres indiquent la longueur d'onde (en nm) des raies spectrales du mercure. Les autres bandes ne portent pas de numéro : ce sont les émissions de phosphores excités par le rayonnement UV du plasma de mercure.
Le spectre d'émission d'une lampe à vapeur de mercure (figure 2) :
Deux représentations du spectre d'une lampe à vapeur de mercure à basse pression.
En revanche, le fait que les "lignes" du spectre ("pics") soient exactement des courbes d'une certaine largeur repose sur des effets quantiques. Ainsi, une comparaison des deux images supérieures (1, 2) montre que les "raies" spectrales s'élargissent avec l'augmentation de la pression de gaz et que la largeur de ces "raies" peut s'élever si haut à très haute pression qu'on a pratiquement un continuum lumineux semblable à celui d'un rayonnement. Solide observé. La cause de cet effet est la fréquence croissante des perturbations mutuelles des atomes lors de leur collision avec une pression croissante. L'exemple de la raie spectrale à 491,6 nm montre clairement à quel point l'intensité relative de cette raie dépend de la pression de gaz respective.
Le spectre d'émission d'une lampe à vapeur de cadmium (figure 3) :
Deux représentations du spectre d'émission d'une lampe à vapeur de cadmium.
Dans l'image inférieure (3), on reconnaît une autre caractéristique des raies spectrales pour l'élément cadmium.
Si, par l'absorption d'un photon, un électron est complètement détaché de son atome, cela s'appelle une ionisation de cet atome, pour lequel, en fonction de l'état initial de l'électron, une certaine énergie minimale est nécessaire. De plus, les approvisionnements en énergie au-delà de cette énergie minimale entraînent toujours une ionisation, ce qui explique pourquoi, contrairement à ce qui a déjà été dit, la poursuite est possible dans ce secteur de l'énergie. Le processus inverse, l'émission d'un photon lors du piégeage d'un électron par un ion positif, est appelé "recombinaison", dans laquelle, comme on vient de l'expliquer, peut également produire un rayonnement continu, appelé "continuum de frontière".
Raies spectrales
Les raies spectrales individuelles de tout spectre (quel qu'il soit) correspondent chacune à la différence d'énergie entre deux états différents de l'atome, qui peut être appliquée, par exemple, par une particule de lumière absorbée (photon), puis émise à nouveau sous la forme d'un autre photon, avec cette énergie.
Cette différence d'énergie (ou dans le spectre, la ligne) est discrète et ne peut donc prendre aucune valeur. Ainsi, chaque atome - en fonction de sa configuration électronique spécifique - ne peut émettre que des photons de longueurs d'onde discrètes très spécifiques, caractéristiques des différents éléments chimiques.
Spectre moléculaire
À la suite d'un spectre, un spectre moléculaire est égal au spectre atomique décrit. Cependant, les niveaux d'énergie sont généralement différents, de même que les lignes pertinentes dans l'infrarouge.
Un spectre moléculaire est un spectre de rayonnement dû aux transitions électroniques et à d'autres changements d'énergie quantique au sein des molécules et constitué d'une série de bandes spectrales caractéristiques qui, lors d'une forte dispersion, sont constituées de raies très fines.
Par un matériau solide ou liquide
Alors que le spectre d'émission de gaz dilués donne un spectre linéaire, les solides et les liquides chauds émettent un spectre continu, car les atomes individuels interagissent en outre, ce qui confond les états quantiques discrets. Un tel spectre continu peut être calculé en multipliant le spectre d'un radiateur à corps noir (loi de Planck du rayonnement) de la même température par le coefficient d'absorption du rayonnement électromagnétique de "l'objet" à la longueur d'onde respective.
Par l'hydrogène
Les électrons peuvent également perdre de l'énergie et descendre à des niveaux d'énergie inférieurs. Lorsqu'un électron descend entre des niveaux, il émet des photons avec la même quantité d'énergie (la même longueur d'onde) qu'il aurait besoin d'absorber pour monter entre ces mêmes niveaux. C'est pourquoi le spectre d'émission de l'hydrogène est l'inverse de son spectre d'absorption, avec des raies d'émission à 410 nm (violet), 434 nm (bleu), 486 nm (bleu-vert) et 656 nm (rouge). La lumière la plus énergétique et la plus courte longueur d'onde est émise par les électrons qui tombent le plus loin.
Synonymes, antonymes
Voir tous les synonymes pour "spectre d'émission".0 synonyme (sens proche) pour "spectre d'émission".
1 antonyme (sens contraire) :
Les mots ou les expressions apparentés à SPECTRE D'ÉMISSION sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
L'expression SPECTRE D'EMISSION est dans la page 4 des mots en S du lexique du dictionnaire.
Mots en S à proximité
spéciation allopatrique spéciation sympatrique spécimen type spectre d'absorption spectre d'action spectre d'émissionspectre lumineux spectre visible spectrine spectrométrie de massespectrophotomètre
En rapport avec "spectre d'émission"

Un albédo est une fraction de la lumière incidente qui est réfléchie par un corps (par exemple les nuages).

Un antibiotique à large spectre précise la nature de l'efficacité d'un antibiotique pour lutter contre une vaste gamme de bactéries pathogènes à Gram positif...
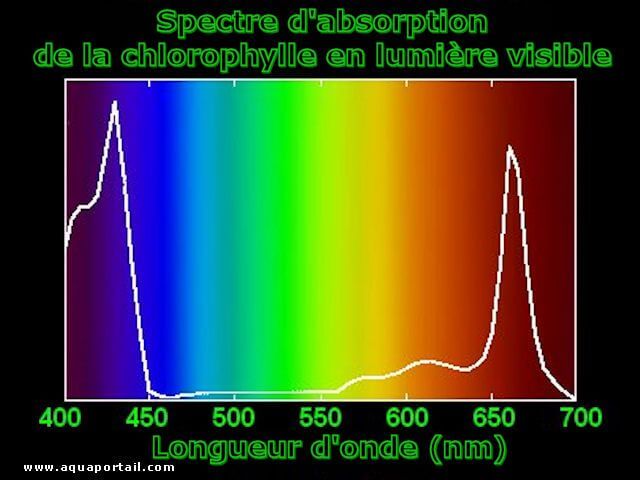
Le spectre d'absorption d'un matériau est la fraction du rayonnement incident absorbé par le matériau sur une plage de fréquences.
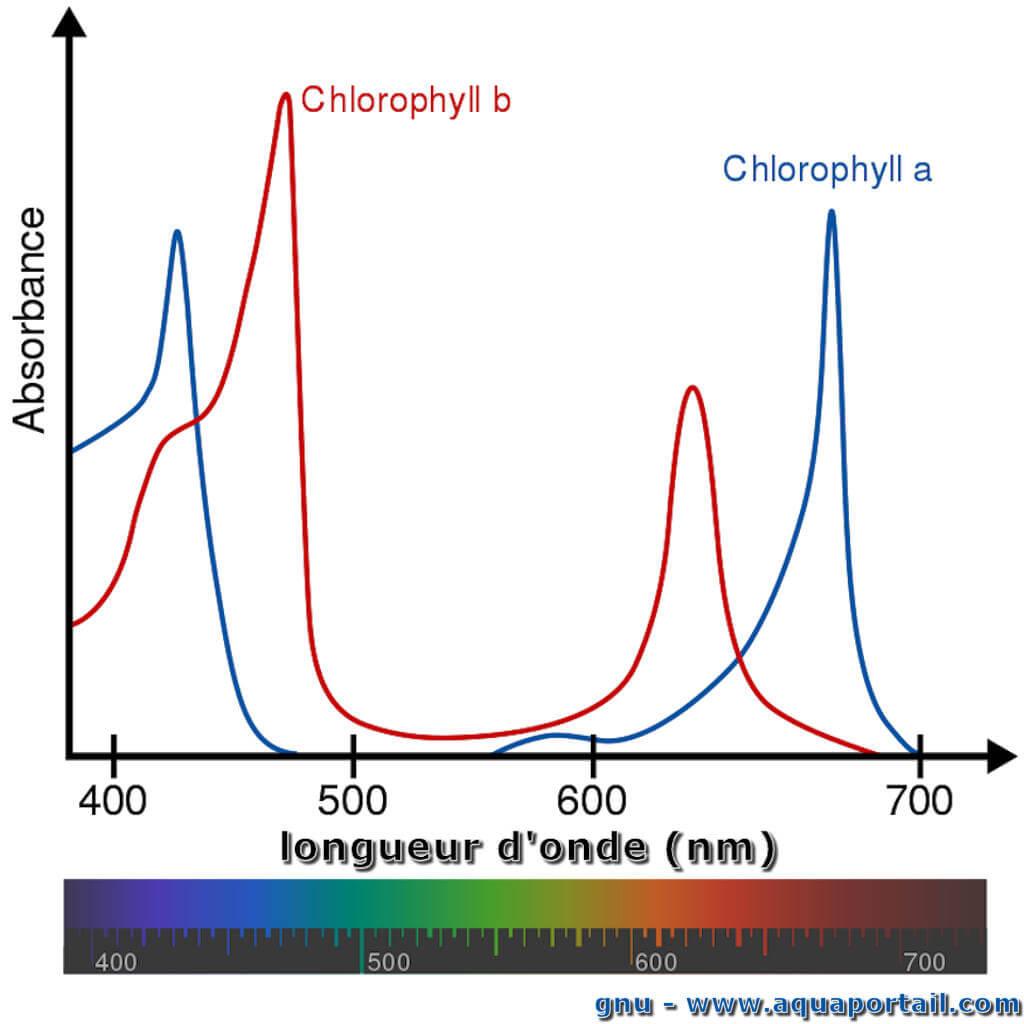
Le spectre d'action correspond à l'intensité de la photosynthèse effectuée par un organisme photosynthétique, en fonction de la longueur d'onde de la lumière...
