Structure de Lewis
Définition
La structure de Lewis est une représentation simplifiée des électrons de la couche de valence impliqués dans les liaisons chimiques. La représentation tient compte de la configuration électronique des atomes formant une molécule. Elle sert à illustrer la manière dont les électrons sont répartis autour des atomes au sein d'une molécule.
Structure de Lewis du trioxyde de soufre SO3 :
Représentation de la structure de Lewis du trioxyde de soufre de formule SO3.
Explications
Dans une représentation de Lewis en deux dimensions, les électrons sont représentés par des "points" ou pour lier des électrons sous forme de ligne entre les deux atomes. Le but est d'obtenir la "meilleure" configuration électronique, avec un respect de la règle de l'octet et des charges formelles.
La structure de Lewis ne tente PAS d'expliquer la géométrie des molécules, la formation des liaisons ou la répartition des électrons entre les atomes. C'est la théorie la plus simple et la plus limitée sur la structure électronique. La structure de Lewis peut être conçue pour toute molécule liée par covalence ainsi que pour les composés de coordination.
Notation de Lewis
La structure de Lewis représente de manière simplifiée les électrons de la couche de valence des atomes au sein d'une molécule. Elle permet de visualiser comment les électrons sont agencés autour des atomes et comment ils participent aux liaisons chimiques. Les électrons sont symbolisés par des points, tandis que les électrons de liaison sont généralement représentés par une ligne reliant les atomes concernés.
Cette méthode, développée en 1916 par le physicien et chimiste américain Gilbert Newton Lewis (1875–1946), repose sur l'idée que les atomes tendent à atteindre une configuration stable en partageant des électrons. Cette stabilité correspond à une structure électronique comparable à celle des gaz rares, c'est-à-dire avec huit électrons dans la couche périphérique, aussi appelée règle de l'octet. La notation de Lewis offre ainsi un outil précieux pour anticiper la formation des liaisons dans une molécule.
Prenons l'exemple de la molécule d'hydrogène, un cas simple. Chaque atome d'hydrogène apporte un électron qui, au lieu d'appartenir exclusivement à chaque atome, est partagé entre les deux noyaux. Cela permet à chaque atome d'hydrogène de se retrouver, au moins partiellement, avec un duo d'électrons en commun.
Formule de Lewis
Les formules de Lewis fournissent une représentation détaillée de la connectivité des atomes, en précisant les types de liaisons présentes (simples, doubles ou triples). Elles incluent également, lorsque nécessaire, les charges formelles et les électrons non partagés qui peuvent exister dans une molécule.
Dans certains cas, il existe des molécules possédant une même formule moléculaire mais ayant différentes connectivités entre leurs atomes; ces substances sont appelées isomères de structure ou isomères de constitution.
Pour les composés organiques, il est courant d'omettre la représentation explicite des doublets libres des halogènes, sauf dans les situations où ces derniers jouent un rôle particulier ou doivent être mis en évidence.
Les formules de Lewis s'appliquent principalement aux composés covalents, mais elles peuvent parfois illustrer, de manière simplifiée, des interactions ioniques dans certains types de substances.
Exemple avec SO3 (trioxyde de soufre)
SO3 (trioxyde de soufre) a un atome de soufre et trois atomes d'oxygène. Dans la structure de Lewis de SO3, il y a trois doubles liaisons autour de l'atome de soufre, avec trois atomes d'oxygène qui lui sont attachés, et sur chaque atome d'oxygène, il y a deux paires isolées.
Comme le soufre et l'oxygène appartiennent au groupe 16 dans la table périodique des éléments, soufre et oxygène ont six électrons de valence. Puisque SO3 a un atome de soufre et trois atomes d'oxygène, les électrons d'un atome de soufre ont une valence de 6 × 1 = 6, et les électrons de trois atomes d'oxygène ont pour valence 6 × 3 = 18. Ainsi, le total des électrons de valence du trioxyde de soufre SO3 = 6 + 18 = 24.
Avec un total de 24 électrons de valence, en divisant cette valeur par deux, la valeur du nombre total de paires d'électrons est obtenue, soit 24 ÷ 2 = 12.
Puisque l'atome le moins électronégatif doit être placé au centre, et puisque le soufre est moins électronégatif que l'oxygène, supposons que l'atome central est le soufre. Par conséquent, le soufre est placé au centre au centre et les oxygènes de chaque côté.
Un total de 12 paires d'électrons et trois liaisons S—O sont déjà marquées. Il suffit alors de marquer les neuf paires d'électrons restantes comme des paires isolées sur le croquis.
Comme le soufre est un élément de période 3, il peut donc conserver plus de 8 électrons dans sa dernière forme. Et l'oxygène est un élément de période 2, il ne peut donc pas garder plus de 8 électrons dans sa dernière forme.
Ainsi, il faut toujours commencer par marquer les paires isolées des atomes extérieurs. Ici, les atomes extérieurs sont des oxygènes. Ainsi, pour chaque oxygène, il y a trois paires isolées, et pour le soufre, il n'y a aucune paire isolée car les neuf paires d'électrons sont terminées.
Synonymes, antonymes
Voir tous les synonymes pour "structure de Lewis".5 synonymes (sens proche) de "structure de Lewis" :
- diagramme de Lewis
- formule de Lewis
- notation de Lewis
- Voir la suite...
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à STRUCTURE DE LEWIS sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
L'expression STRUCTURE DE LEWIS est dans la page 5 des mots en S du lexique du dictionnaire.
Mots en S à proximité
strontium strophiole structure aromatique structure chimique structure d'assemblage structure de Lewisstructure du sol structure en canaux structure en piliers structure étoiléestructure fluidale
En rapport avec "structure de Lewis"
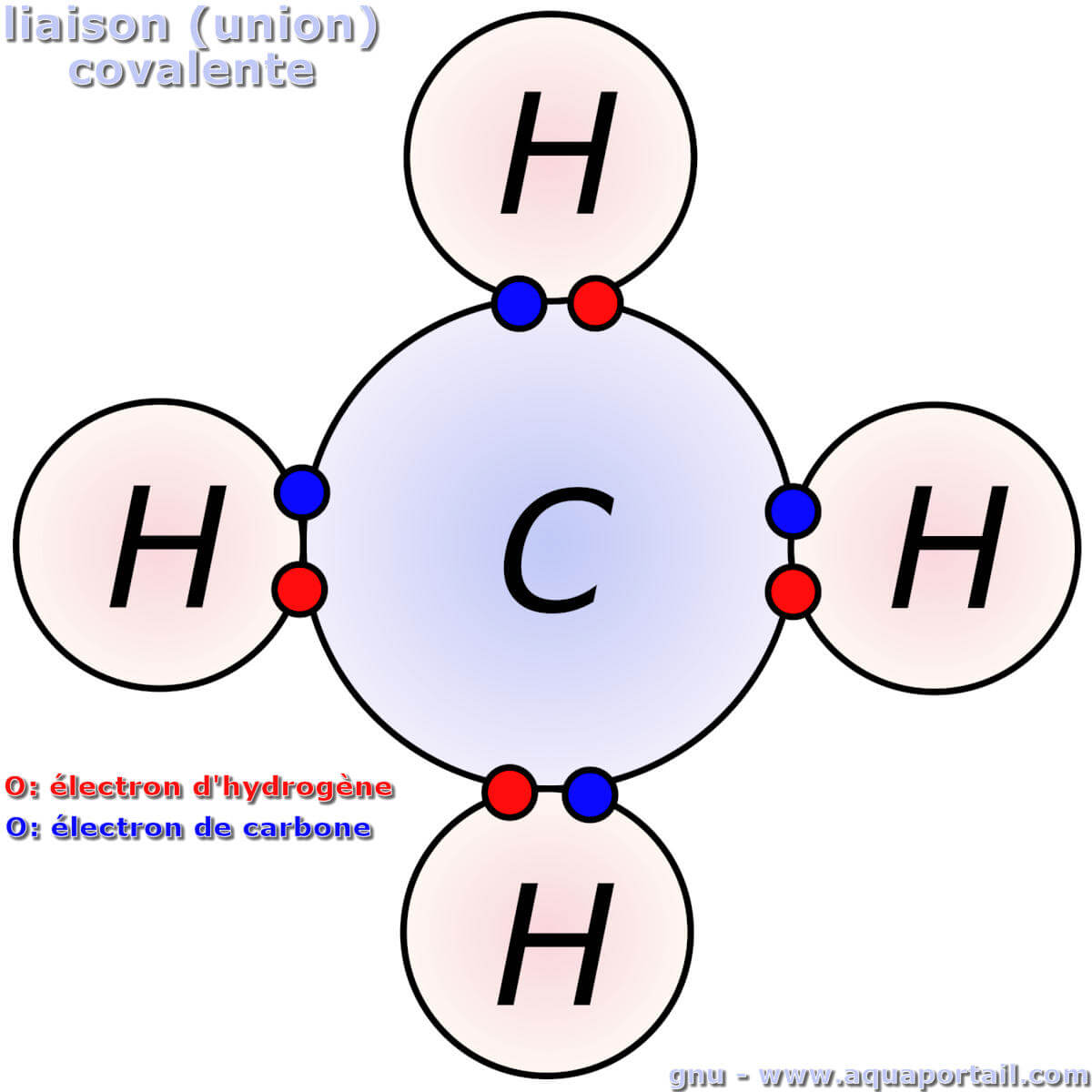
Une liaison covalente est l'union de deux atomes non métalliques par le partage d'électrons dans une molécule.

Une structure chimique d'une molécule comprend la disposition des atomes et les liaisons chimiques qui maintiennent les atomes ensemble.

Le trioxyde de soufre (SO₃, anhydride sulfurique) est un solide cristallin incolore à blanc qui fond dès 16,9°C.
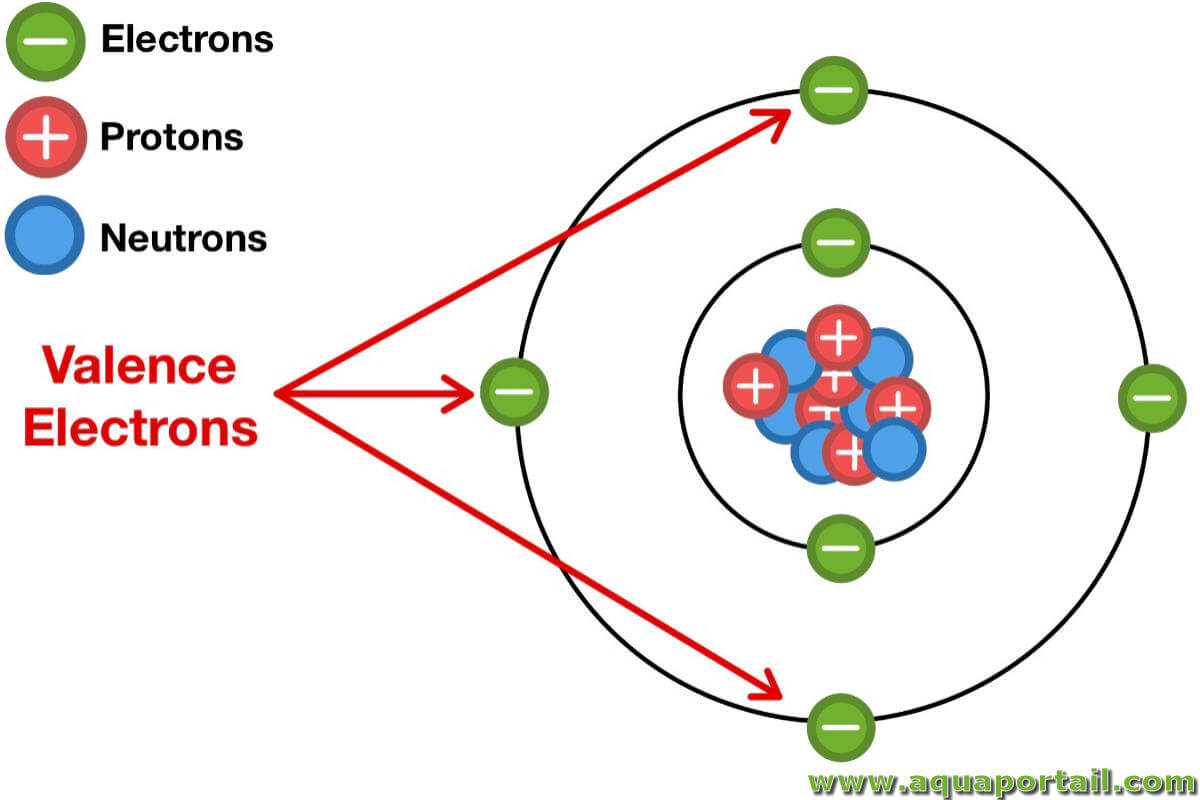
En chimie, la valence est la capacité de liaison d'un atome ou d'une molécule, telle que la valence d'un anticorps.
